
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)3.4g NH3中含有________mol H。
(2)标准状况下,等体积的CO和CO2的质量比为________。
(3)100 mL Al2(SO4)3溶液中c (Al3+)=0.20 mol·Lˉ1,则c(SO42-)=_______。
(4)物质的量浓度相同的NaCl、MgCl2、AlCl3溶液中分别加入足量的AgNO3溶液中,生成沉淀的质量相等,三种溶液的体积比为__________。
【答案】0.6 7:11 0.3 mol/L 6:3:2
【解析】
(1)根据n=![]() 计算出氨气的物质的量;(2)根据阿伏加德罗定律,标准状况下,等体积的CO和CO2的物质的量相等;(3)Al2(SO4)3溶液中c (Al3+): c(SO42-)=2:3;(4)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,生成的AgCl沉淀的质量之比为1:1:1,令生成AgCl分别为1mol、1mol、1mol,根据氯原子守恒计算三种溶液的体积比。
计算出氨气的物质的量;(2)根据阿伏加德罗定律,标准状况下,等体积的CO和CO2的物质的量相等;(3)Al2(SO4)3溶液中c (Al3+): c(SO42-)=2:3;(4)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,生成的AgCl沉淀的质量之比为1:1:1,令生成AgCl分别为1mol、1mol、1mol,根据氯原子守恒计算三种溶液的体积比。
(1)根据n=![]() ,氨气的物质的量=
,氨气的物质的量=![]() ,氢原子的物质的量是0.6mol;(2)根据阿伏加德罗定律,标准状况下,等体积的CO和CO2的物质的量相等,设物质的量都是nmol,则CO和CO2的质量分别是28ng、44ng,质量比是7:11;(3)Al2(SO4)3溶液中c (Al3+): c(SO42-)=2:3,所以当c (Al3+)=0.20 mol·Lˉ1时,c(SO42-)=0.30 mol·Lˉ1;(4)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,生成的AgCl沉淀的质量之比为1:1:1,令生成AgCl分别为1mol、1mol、1mol,根据氯原子守恒,则n(NaCl)=1mol、n(MgCl2)=
,氢原子的物质的量是0.6mol;(2)根据阿伏加德罗定律,标准状况下,等体积的CO和CO2的物质的量相等,设物质的量都是nmol,则CO和CO2的质量分别是28ng、44ng,质量比是7:11;(3)Al2(SO4)3溶液中c (Al3+): c(SO42-)=2:3,所以当c (Al3+)=0.20 mol·Lˉ1时,c(SO42-)=0.30 mol·Lˉ1;(4)相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,生成的AgCl沉淀的质量之比为1:1:1,令生成AgCl分别为1mol、1mol、1mol,根据氯原子守恒,则n(NaCl)=1mol、n(MgCl2)=![]() mol、n(AlCl3)=
mol、n(AlCl3)=![]() mol,根据c=
mol,根据c=![]() 可知,浓度相同条件下,体积之比等于其物质的量之比,故V(NaCl溶液):V(MgCl2溶液):V(AlCl3溶液)=1mol:
可知,浓度相同条件下,体积之比等于其物质的量之比,故V(NaCl溶液):V(MgCl2溶液):V(AlCl3溶液)=1mol:![]() mol:
mol:![]() mol=6:3:2。
mol=6:3:2。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列物质所含分子数最少的是
A. 6 mol CO2 B. 6g氢气 C. 标准状况下,224L氨气 D. 含氧分子数为4NA的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
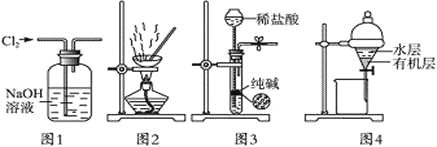
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. CO的摩尔质量为28g
B. 1mol·L-1 NaOH溶液中所含有Na+数目为NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“冰→液体水→氢气和氧气”的变化过程中,微粒间被破坏的作用力依次是( )
A.范德华力、范德华力
B.范德华力、共价键
C.共价键、范德华力
D.共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
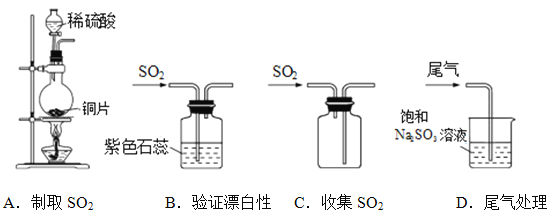
【题目】葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
I.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是____________
(2)设计实验验证SO2与Fe2+ 还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_________溶液,观察到_____________, 可知混合液中无Fe3+;
向乙中滴加_________溶液,观察到______________,可知混合液中有__________由此得出结论:SO2的还原性强于Fe2+ 。
II.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或HSO3-。设计如图1的实验:
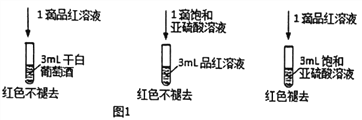
甲同学得出实验结论:干白葡萄酒中不含SO2或HSO3-。这个结论是否合理_____(填“是”或“否”)说明理由__________________________________________。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
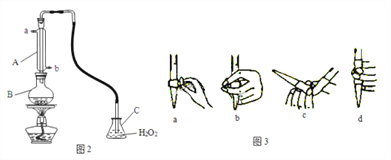
实验步骤:
i. 检查装置的气密性后,向图2仪器B中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与C中H2O2完全反应
iii. 除去C中过量的H2O2
iv. 用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①仪器A的名称是____,A的进水口为____,滴定前排气泡时,应选择图3中的___。
②C中反应生成物的化学式是________,除去过量H2O2的方法是_________________。
③滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为____g/L,是否符合国家标准________(填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是______________。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加Fe(s)的量
B.将容器的体积缩小一半
C.升高温度
D.通入水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,在原理上可以设计成原电池的是( )
A.Ba(OH)28H2O与NH4Cl的反应
B.铝片与浓硫酸的反应
C.甲烷与氧气的反应
D.石灰石的分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com