
【题目】KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸lh;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?__
(2)为什么不用普通滤纸过滤器过滤?___
(3)如何保证在70℃~80℃条件下进行滴定操作:___
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是__
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取Wg草酸晶体(H2C2O4·2H2O)溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。6H++2MnO4-+5H2C2O4·2H2O=2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在__;
②滴定终点标志是___;
③KMnO4溶液的物质的量浓度为___;
④若滴定前平视,滴定后俯视,则测得的浓度值将__(填“偏高”或偏低)
【答案】有部分KMnO4被还原成MnO(OH)2 KMnO4的强氧化性能氧化滤纸 可在水浴中加热 A 酸式滴定管 当最后滴下1滴KMnO4溶液后半分钟不褪色时 ![]() 偏高
偏高
【解析】
(1)高锰酸钾易被还原;
(2)高猛酸钾具有强氧化性;
(3)水浴加热温度较低;
(4)基准试剂要求是纯度高、稳定性好的物质;
(5)①滴定时,酸性溶液要盛放在酸式滴定管中;
②滴定终点时最后滴下1滴KMnO4溶液后半分钟不褪色;
③先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
④根据![]() 分析。
分析。
(1)根据题意知,高锰酸钾易被空气中某些还原性物质含有生成MnO(OH)2,所以要要称取稍多于所需的KMnO4固体,故答案为:有部分KMO4被还原成MnO(OH)2;
(2)KMnO4的强氧化性能氧化滤纸;
(3)直接加热温度较高,可用水浴加热,以使温度控制在70℃~80℃,故答案为:可在水浴中加热;
(4)A.H2C2O42H2O溶于水后纯度高、稳定性好,符合要求,故A正确;
B.FeSO47H2O不稳定易被氧气氧化,故B错误;
C.浓盐酸不稳定,易挥发,故C错误;
D.Na2SO3具有还原性,易被氧化而变质,故D错误;
故选A;
(5)①滴定时,高锰酸钾溶液中加入了稀硫酸而使溶液呈酸性,酸性溶液要盛放在酸式滴定管中,故答案为:酸式滴定管;
②当最后滴下1滴KMnO4溶液后半分钟不褪色时,说明滴定到达终点,故答案为:最后滴下1滴KMnO4溶液后半分钟不褪色;
③草酸的物质的量浓度=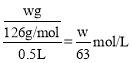 ,由反应可知高锰酸钾与草酸的物质的量之比为2:5,则有
,由反应可知高锰酸钾与草酸的物质的量之比为2:5,则有![]() =
=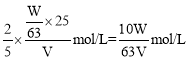 ;
;
④若滴定前平视,滴定后俯视,导致V(待测)偏小,则c(待测)偏高,故答案为:偏高。


科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g)![]() 2CO(g) △H>0,达到平衡状态,进行如下操作:
2CO(g) △H>0,达到平衡状态,进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④B.①③C.①②D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g)△H=-QJ/mol(Q>0)。下列说法不正确的是( )
2SO3(g)△H=-QJ/mol(Q>0)。下列说法不正确的是( )
A.生成2molSO3,需要lmolO2参加反应
B.将2molSO2(g)和1molO2(g)充入一密闭容器中反应,放出QkJ的热量
C.加入催化剂,增大了活化分子百分数,加快了反应速率,降低了生产成本
D.2molSO2(g)和1molO2(g)的能量之和高于2molSO3(g)的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)![]()
(1)反应(Ⅰ)中氧化剂是___。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)![]() 2NO2(g) ΔH(Ⅱ)
2NO2(g) ΔH(Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)中ΔH___0(填“>”或“<”),保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,混合气体的颜色__(填“变深”或“变浅”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.7.8g苯所含碳碳双键数目为0.3NAB.28g乙烯所含共用电子对数目为5NA
C.标准状况下,11.2L乙醇所含分子数为0.5NAD.16g甲烷电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),一定条件下测得反应过程中n(Cl2)与时间的关系如表所示:则4~6min内用O2的物质的量变化表示的反应速率是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |
A.7.2molmin-1B.8.0molmin-1C.0.9molmin-1D.0.45molmin-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。

(1)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是___。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
①写出CO与NO反应的化学方程式:___,该反应作氧化剂的物质是__。
②用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH2
若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=___。
(3)有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
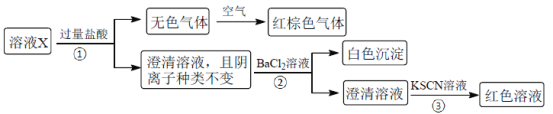
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com