
【题目】如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入等物质的量的Na、Na2O、Na2O2、NaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
【答案】B
【解析】
设钠、氧化钠、过氧化钠和氢氧化钠的物质的量均为0.1mol:
Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
氢氧化钠溶于水,与水不反应,溶液增加的质量=m(NaOH)=4.0g;
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol;
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得氢氧化钠溶液的质量分数分别为:![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙,故选B。
×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙,故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
A.CO的转化率将增大 B.达到新平衡时的反应热ΔH > —Q
C.气体的密度将不变 D.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g)
2NH3(g)
①达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
A.6 molH2 + 4 molN2
B.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
C.3 molH2+ 1 molN2 + 2 mol NH3
② 若是在恒温恒容的容器中反应,达到平衡时NH3的浓度为c1 mol·L-1,则c________c1(填“<”“>”或“=”),原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是

A. 正反应的活化能等于逆反应的活化能
B. a曲线是加入催化剂时的能量变化曲线
C. 1 mo N2与3 mo H2充分反应放出的热量小于92 kJ
D. 加入催化剂,该反应的焓变减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体,下列说法正确的是( )
白色固体,下列说法正确的是( )
A.①发生了化合反应B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液。此过程中溶液pH变化的曲线如图所示。下列叙述中正确的是
时,先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液。此过程中溶液pH变化的曲线如图所示。下列叙述中正确的是![]()
![]()

A. ①点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)+c(ClO-)
B. ②点的溶液中:c(H+)> c(Cl-)>c(ClO-)> c(HClO)
C. ③点的溶液中:c(K+)=c(ClO-)+c(Cl-)
D. ④点的溶液中:c(K+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③标准状况下,22.4 L H2O中分子数为NA
④32 g O2和O3混合气体中含有原子数为2NA
A.①②③④B.①②④C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 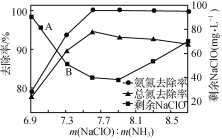 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线。下列叙述错误的是( )

A. t1℃时,三种物质的溶解度大小顺序为C>B>A
B. 当A中混有少量B 时,可用降温结晶的方法提纯A
C. 将A、B、C的饱和溶液从t3℃降温到t2℃,溶液中均有固体析出
D. 若要将N点的A溶液转变为M点的A溶液,可在恒温条件下采用蒸发溶剂法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com