
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中常温下A、B单质是气体,C、D单质是固体。
(1)写出四种元素的名称:A___________B____________C___________D___________。
(2)用电子式表示A2B的形成过程: _________________________。
(3)由B、C两元素所形成的原子个数比为1:1的化合物属于__________(填“离子”或“共价”)化合物,写出它与水反应的离子方程式______________________。
(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为_____________。
(5)A2B和A2D的沸点较高者为______________(填化学式)。
【答案】氢 氧 钠 硫 ![]() 离子 2Na2O2+2H2O=4Na++4OH-+O2↑ 2H2O2
离子 2Na2O2+2H2O=4Na++4OH-+O2↑ 2H2O2 ![]() 2H2O+O2↑ H2O
2H2O+O2↑ H2O
【解析】
A、B、C、D是四种短周期元素,它们的原子序数依次增大,A元素的原子半径是所有主族元素中原子半径最小,则A为氢元素;A、C及B、D分别是同主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍,则B、D在二、三周期,故C处于第三周期,则C为钠元素;B、D分别是同主族元素,B、D两元素的原子核中质子数之和为2(1+11)=24,故B为氧元素,D为硫元素;其中四种元素所形成的单质中A、B单质是气体,C、D单质是固体,符合题意.
根据以上A为氢元素,B为氧元素,C为钠元素,D为硫元素
(1)四种元素的名称:A 、氢 B、 氧 C、钠 D、 硫。故答案为:A 、氢 B、 氧 C、钠 D、 硫。
(2)水分子是共价化合物,氧原子与氢原子形成两个共用电子对,用电子式表示H2O的形成过程:![]() 。故答案为:
。故答案为:![]() ;
;
(3)B为氧元素,C为钠元素,由两元素所形成的原子个数比为1:1的化合物为Na2O2,由钠离子与过氧根离子构成,属于离子化合物,钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间为非极性键;过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:离子;2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)A为氢元素,B为氧元素,两元素所形成的原子个数为1:1的化合物为H2O2,实验室常用H2O2气体O2,反应方程式为2H2O2![]() 2H2O+O2↑ ,故答案为:2H2O2
2H2O+O2↑ ,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(5)水分子间形成氢键,H2O和H2S的沸点较高者为H2O。故答案为:H2O。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种氨化剂,易水解,难溶于CCl4。某小组设计下图所示装置制备氨基甲酸铵。已知:2NH3(g) + CO2(g)![]() H2NCOONH4(s) H<0。
H2NCOONH4(s) H<0。
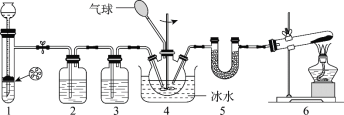
下列分析不正确的是
A.2中的试剂为饱和NaHCO3溶液
B.冰水浴能提高H2NCOONH4的产率
C.1和4中发生的反应均为非氧化还原反应
D.5中的仪器(含试剂)可用3中仪器(含试剂)代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用FeCl3溶液制作铜质印刷线路板:2Fe3++ Cu = Cu2++ 2Fe2+
B.Al片溶于NaOH溶液中产生气体:2Al + 2OH-=2![]() + H2↑
+ H2↑
C.用难溶的MnS除去MnCl2溶液中含有的Pb2+:MnS(s) + Pb2+(aq) =PbS (s) + Mn2+(aq)
D.向银氨溶液中滴加乙醛后水浴加热,出现银镜:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(![]() )氮原子上的氢原子可以像苯酚分子中苯环上的氢原子那样与甲醛发生反应,生成交联脲醛树脂,其结构片段如下图所示(图中 表示链延长)。
)氮原子上的氢原子可以像苯酚分子中苯环上的氢原子那样与甲醛发生反应,生成交联脲醛树脂,其结构片段如下图所示(图中 表示链延长)。
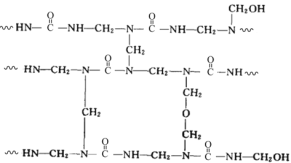
下列说法不正确的是
A.尿素可以与甲醛发生加成反应生成 ![]()
B.脲醛树脂的合成反应为缩聚反应
C.交联脲醛树脂在一定条件下可以发生水解反应,重新生成尿素和甲醛
D.甲醛可以与![]() 交联成网状结构的脲醛树脂
交联成网状结构的脲醛树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
| 蒸馏水 | I.钠浮在水面,剧烈反应,有少量白雾 |
0.1 mol·L-1盐酸 | II.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | III.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.II中反应的离子方程式为2Na + 2H+ === 2Na+ + H2↑
B.对比I、II、III可知,随着c(H+) 增大,反应的剧烈程度增大
C.实验I、II、III均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测III中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
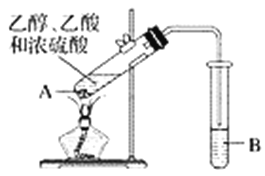
(1)试管A混合溶液的加入顺序是__________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________。
(5)试管B中可能观察到的现象是______________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 容器内n(A2):n(B2):n(AB)=1:1:2
B. 容器内气体的密度不随时间变化
C. 容器内气体的总压强不随时间变化
D. 单位时间内生成2n mol AB,同时生成n mol A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
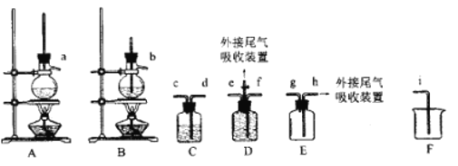
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com