
����Ŀ����ҵ�ϣ�����ұǦ����(����Pb��PbO��PbS��PbCO3��Pb(OH)2��C�Լ�Fe�����������)��ȡ���·�(ZnS��BaSO4)������ȡǦ�Ĺ����������£�
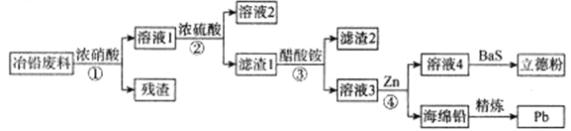
��֪��
�ٴ���Ǧ������ˮ���ѵ��롣
�ڳ����£�Ksp(PbSO4)=1.6��10��8��Ksp(PbCO3)=8.0��10��14��
�ش��������⣺
(1)Ϊ�˼ӿ�ٵķ�Ӧ���ʣ�ͨ��ѡ��6mol/L�������60��ķ�Ӧ���������¶ȼ������ߣ����������ڷ�Ӧ�Ľ��У�ԭ�������___________��
(2)���������ʵ���ҽ��з����������IJ���������___________������1����Ҫ�ɷ�������Ǧ��ϴ������Ǧ���ѡ��___________��
A.����ˮ B.�� C.ϡ���� D.����̼����
(3)д������۷�Ӧ�����ӷ���ʽ___________��
(4)���õ�ⷨ����Ǧ������Ǧ���ӵ�Դ��___________��(��������)������Ǧ�ĵ缫��ӦʽΪ___________��
(5)������Ǧ����1t(��Ǧ��PbO�ƣ���������Ϊ11.15%)����������Ϊ90%����õ���Ǧ����___________g��
���𰸡��¶ȹ��ߣ������ֽ� ©�����ձ��������� C PbSO4��2CH3COO��=(CH3COO)2Pb��SO42�� ���� Pb2����2e��=Pb 9.315��104
��������
��1��ͨ��ѡ��6mol/L�������60��ķ�Ӧ�������¶ȹ����������ֽ⡣
��2������ܷ�Ӧ��ķ�������ǹ��ˣ�ѡ©�����ձ�����������ϴ������ǦҪϴȥ�������������ʣ���Ҫ������ʧ�����ѡ��ϡ���ᡣ
��3������۷�Ӧ�����ӷ���ʽPbSO4��CH3COO����������������ˮ���ѵ����(CH3COO)2Pb��
��4�����õ�ⷨ����Ǧ������Ǧ���ӵ�Դ��������ǦԪ�ػ��ϼ����ߣ�����Ǧ�ĵ缫��Ӧʽ��Pb2����2e��=Pb
��5������Ǧ�غ���㡣
��1�����������ֽ������¶Ȳ���̫����
��2������ܷ�Ӧ��ķ������Ϊ��������������IJ������������ձ���©���Ͳ�������ϴ������ǦҪϴȥ������������������Ҫ������ʧ����A�����������Ǧ�����ܽ���B.���������Ӳ����ܽ�������ϴȥ��C��ϡ�����ܹ�ϴȥ������ͬʱ�ɼ�������Ǧ���ܽ���D��������������Ǧ��ת��Ϊ̼��Ǧ���������ʡ���ѡC��
��3�����������Ǧ������ˮ���ѵ������ʷ�Ӧ�����ӷ���ʽΪPbSO4��2CH3COO��=(CH3COO)2Pb��SO42����
��4�����õ�ⷨ����Ǧ������Ǧ���ӵ�Դ��������ǦԪ�ػ��ϼ����ߣ�����Ǧ�ĵ缫��Ӧʽ��Pb2����2e��=Pb��
��5������ǦԪ���غ�ɵ�Ϊ![]() =9.315��104g��
=9.315��104g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SiO2�㷺������Ȼ���У�����;Ҳ�dz��㷺��������������ά��Ҳ���������뵼����Ϲ衣
��1��д����ҵ���Ʊ��ֹ�Ļ�ѧ��Ӧ����ʽ_________________��
��2��SiO2��ʴ��������������ᣬд����ѧ��Ӧ����ʽ�� ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����ij�εijɷ֣� ��������ʵ�飺
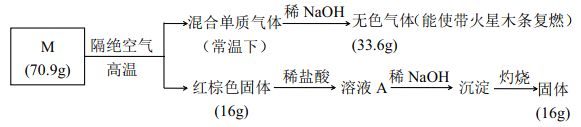
��ش�
��1���� M �Ļ�ѧʽ��_________��
��2���� NaOH ���յ�����ĵ���ʽ____________��
��3������Һ A ��ͨ��H2S ���壬 �е���ɫ���������� д����Ӧ�����ӷ���ʽ________ (�����ǿ�����Ӱ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ��װ��Ʒ����Ҫ�ɷ֣��ǵؿ��к�����ߵ�����Ԫ���γɵĻ����������ͼת����ϵ���ش��������⡣

(1)A����;��________(��дһ��)��B��________��D��________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ����______________��
(3)д�����з�Ӧ�����ӷ���ʽ����____________����_______����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ�����е������仯��ͼ��ʾ��ͼ��E1��ʾ����ʱ����Ӧ�Ļ�ܣ�E2��ʾ����ʱ�淴Ӧ�Ļ�ܣ��������й���������ȷ����
2SO3(g)��Ӧ�����е������仯��ͼ��ʾ��ͼ��E1��ʾ����ʱ����Ӧ�Ļ�ܣ�E2��ʾ����ʱ�淴Ӧ�Ļ�ܣ��������й���������ȷ����

A. �÷�Ӧ���淴ӦΪ���ȷ�Ӧ�������¶ȿ������ӵİٷ���
B. 500�桢101kPa�£���1molSO2(g)��0.5molO2(g)�����ܱ������г�ַ�Ӧ����SO3(g)����akJ�����Ȼ�ѧ����ʽΪ2SO2(g)+O2(g)![]() 2SO3(g) ��H=-2a kJ��mol-l
2SO3(g) ��H=-2a kJ��mol-l
C. �÷�Ӧ�У���Ӧ����ܼ���С����������ܼ���
D. ��H=E1-E2��ʹ�ô����ı��ܣ������ı䷴Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KIO3�ɲ��õ�ⷨ�Ʊ���װ����ͼ��ʾ������������ȷ����

A. ͨ��������ĵ缫��Ӧʽ2H2O+2e-=2OH-+H2��
B. ��������ͨ�������ӽ���Ĥ��������ҪΪK+����Ǩ�Ʒ����Ǵ��ҵ���
C. ����������������pH����
D. ����·��ͨ��1mol���ӵĵ���ʱ������0.5mol��KIO3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����(N2H4��H2O)����ɫ����ǿ��ԭ�Ե�Һ�壬ʵ�����Ƹ�ˮ���µ�ԭ��Ϊ��CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4��H2O+NaCl �ݴˣ�ijѧ�����������ʵ�顣
����1���Ʊ�NaC1O��Һ����֪��3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)���ռ��������30��NaOH��Һʱ�����貣����������Ͳ���_______(����ĸ)��
A������ƿ B���ձ� C����Һ�� D��������
(2)װ��A�з�����Ӧ�����ӷ���ʽ��__________����װ��C�г��ֶ�����������a�е�����Ϊ_______________��B���ñ�ˮԡ�����¶���30�����£�����ҪĿ����______________��
����2����ȡˮ���¡�
���Ʒ�Ӧ�¶ȣ�����Һ©���е���Һ��������������ƿ�У���ַ�Ӧ����������������ƿ�ڵ���Һ���ռ�108~114����֡�(��֪��N2H4��H2O+2NaC1O=N2��+3H2O+2NaC1)��
(3)��Һ©���е���Һ��___________(����A������B��)��
A��NaOH��NaC1O�����Һ B��CO(NH2)2��Һ

����3���µ����ʷ�����ⶨ��
(4)ˮ�����백ˮ�������ƣ����ڶ�Ԫ���ˮ���������ᷴӦ���������λ�ѧʽΪ_______________��
(5)ˮ���¾��л�ԭ�ԣ����������ɵ�������ȡ���0.3000g����ˮ��ɼ�20.00mL��Һ��һ����������0.1500 mol/L��I2��Һ�ζ���
��ˮ���������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��ʵ��������I2��Һ��ƽ��ֵΪ20.00mL�������N2H4��H2O����������Ϊ__________��(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2mol B������2 L���ܱ������л�ϣ�����һ�������·������·�Ӧ��2A(g)+B(g)![]() 2C(g)����Ӧ2 s����C�����ʵ���Ϊ1.2mol������˵������ȷ����
2C(g)����Ӧ2 s����C�����ʵ���Ϊ1.2mol������˵������ȷ����
A.������B��ʾ2s�ڵ�ƽ����Ӧ����Ϊ0.15 mol/(L��s)
B.������A��ʾ2 s�ڵ�ƽ����Ӧ����Ϊ0.3 mol/(L��s)
C.2 s������B��Ũ��Ϊ0.35 mol/L
D.2 s������A��ת����Ϊ30%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йشӺ�������ȡ���ʵ��ԭ����װ���ܴﵽʵ��Ŀ�ĵ���

A. ��װ�ü������麣��
B. ��װ���ҹ��˺����ҵĽ���Һ
C. ��װ�ñ��Ʊ�������������Һ��I��Cl2
D. ��װ�ö�������������Һ��I���Cl2β��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com