
【题目】某研究性学习小组探究碳化铝的性质:发现碳化铝与水在常温下剧烈反应,生成大量气体和白色沉淀,该沉淀既能溶于盐酸也能溶于NaOH溶液,该小组同学为了探究气体产物的组成,设计出如图1所示实验: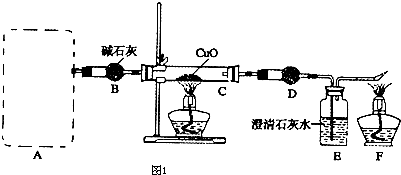
(1)利用碳化铝制取气体,图2装置中适合作为气体发生装置的是 . 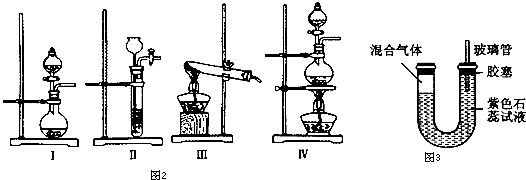
(2)正确选择发生装置后,连接装置进行实验.一段时间后,硬质玻璃管C中黑色粉末变成红色,干燥管D中白色粉末变成蓝色,装置E中澄清石灰水变浑浊,尾气燃烧产生蓝色火焰.①干燥管D中的试剂可能是 , 其作用是 .
②根据实验现象,某同学得出下列推论,其中正确的是 .
a.气体与氧化铜在一定条件下反应,氧化产物只有二氧化碳
b.气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳
c.气体与氧化铜在一定条件下反应,产物一定有水、二氧化碳和一氧化碳
d.气体具有还原性,氧化产物可能有多种
(3)实验完毕后,要先后熄灭C和F处的酒精灯,应后熄灭的是处酒精灯,理由是 .
(4)若最后在F处点燃气体与在A处产生的气体相同,实验前系统内的空气已排尽,实验验结束后,C装置减轻12.8g,D装置增重7.2g,E装置增重8.8g(假定D、E吸收气体是完全的),则A、C处发生反应的方程式分别为、 .
(5)如图3所示,U型透明玻璃管的左端封闭有A处产生气体和氯气的混合气,将该装置放在日光灯下.一段时间后(不考虑水与氯气的反应),下列关于U型管中可能出现的现象的叙述中正确的是a.U型管左侧会有油状液滴出现
b.溶液很快变成蓝色
c.气柱缩小,右端液柱下降
d.气柱膨胀,右端玻璃管中液体溢出.
【答案】
(1)Ⅰ
(2)无水硫酸铜;检验甲烷与氧化铜反应的产物是否含有水;bd
(3)C;停止加热C玻璃管后,继续通入甲烷至玻璃管冷却,避免炽热铜粉被氧化,且尾气是可燃气体,可能含有有毒的CO,要用燃烧法除去
(4)Al4C3+12H2O=4Al(OH)3+3CH4↑;CH4+4CuO ![]() 4Cu+CO2+2H2O
4Cu+CO2+2H2O
(5)ac
【解析】解:(1)根据碳化铝与水在常温下剧烈反应,生成大量气体,故利用碳化铝制取气体,图2中适合作为气体发生装置的是Ⅰ,因为装置Ⅰ适合于固体和液体在常温下制取气体,而且能够很好的控制反应的进行和开始,并能够控制反应速率,所以答案是:Ⅰ;(2)①根据一段时间后,干燥管D中白色粉末变成蓝色等现象,可知干燥管D中的试剂可能是无水硫酸铜,其作用是 检验甲烷与氧化铜反应的产物是否含有水,所以答案是:无水硫酸铜;检验甲烷与氧化铜反应的产物是否含有水;②根据实验现象,可知气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳,气体具有还原性,氧化产物可能有多种;所以答案是:bd;(3)实验完毕后,应后熄灭的是 C处酒精灯,理由是 停止加热C玻璃管后,继续通入甲烷至玻璃管冷却,避免炽热铜粉被氧化;尾气是可燃气体,可能含有有毒的CO,要用燃烧法除去,所以答案是:C;停止加热C玻璃管后,继续通入甲烷至玻璃管冷却,避免炽热铜粉被氧化,且尾气是可燃气体,可能含有有毒的CO,要用燃烧法除去;(4)若最后在F处点燃气体与在A处产生的气体相同,说明无一氧化碳生成,由C装置减轻12.8g,可推知参加反应的氧化铜的质量为:12.8× ![]() =64g,其中氧元素的质量为12.8g;由D装置增重7.2g,可推知生成水的质量为7.2g,其中氢、氧元素质量分别为:0.8g、6.4g;由E装置增重8.8g可知生成二氧化碳的质量为8.8g,其中含碳、氧元素的质量分别为:2.4g、6.4g;然后根据元素守恒可知:与氧化铜反应的气体是甲烷,则A、C处发生反应的方程式分别为 Al4C3+12H2O=4Al(OH)3+3CH4↑、CH4+4CuO
=64g,其中氧元素的质量为12.8g;由D装置增重7.2g,可推知生成水的质量为7.2g,其中氢、氧元素质量分别为:0.8g、6.4g;由E装置增重8.8g可知生成二氧化碳的质量为8.8g,其中含碳、氧元素的质量分别为:2.4g、6.4g;然后根据元素守恒可知:与氧化铜反应的气体是甲烷,则A、C处发生反应的方程式分别为 Al4C3+12H2O=4Al(OH)3+3CH4↑、CH4+4CuO ![]() 4Cu+CO2+2H2O,所以答案是:Al4C3+12H2O=4Al(OH)3+3CH4↑;CH4+4CuO
4Cu+CO2+2H2O,所以答案是:Al4C3+12H2O=4Al(OH)3+3CH4↑;CH4+4CuO ![]() 4Cu+CO2+2H2O;(5)甲烷与氯气反应,产生不溶于水的油状有机物和氯化氢,消耗氯气,且生成的HCl能够溶解于水,气体的物质的量减少,所以压强减小,U型管右端的玻璃管中水柱降低,由于HCl溶解于水显酸性,能使紫色石蕊试液变红色,所以答案是:ac.
4Cu+CO2+2H2O;(5)甲烷与氯气反应,产生不溶于水的油状有机物和氯化氢,消耗氯气,且生成的HCl能够溶解于水,气体的物质的量减少,所以压强减小,U型管右端的玻璃管中水柱降低,由于HCl溶解于水显酸性,能使紫色石蕊试液变红色,所以答案是:ac.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是
A. 短周期是指第一、二、三、四周期
B. 周期表中的第五列是ⅤA族
C. 元素周期表有18个族
D. 元素周期表中含元素最多的族是ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包粉末可能含有K+、Fe3+、Al3+、Cl﹣、SO42﹣、CO32﹣中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后,滤液呈中性,在滤液中滴入AgNO3溶液,有白色沉淀生成;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤.往得到的沉淀中加入过量的NaOH溶液,沉淀减少.
(1)根据上述实验,这包粉末中一定不含有的离子是 , 肯定含有的离子是 , 不能确定是否含有的离子是 , 可通过实验来进一步确定该离子.
(2)写出⑤中生成有色沉淀反应的离子方程式:
(3)写出⑤中沉淀减少反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是化合反应,又是氧化还原反应的是( )
A.2CO+O2 ![]() 2CO2
2CO2
B.CaO+H2O=Ca(OH)2
C.C+H2O ![]() CO+H2
CO+H2
D.CO2+Ca(OH)2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是科学与技术发展的基础。
①合金有许多特点。下列物质中,不属于合金的是________(填字母)。
a. 硬铝 b. 水银 c. 钢铁
②纳米陶瓷成功地解决了陶瓷易碎的问题。纳米陶瓷属于________(填字母)。
a. 无机非金属材料 b. 金属材料 c. 高分子材料
③“神九”国产“飞天”舱外服由六层组成。从内到外依次为由特殊防静电处理过的棉布组成的舒适层、合成橡胶质地的备份气密层、复合材料结构组成的主气密层、涤纶面料的限制层、隔热层和最外防护层。其中由天然有机高分子材料组成的层是_______(填字母)。
a. 舒适层 b. 备份气密层 c. 主气密层
④生产玻璃时,纯碱与石英反应的化学方程式为_________________。氮化硅陶瓷是一种高温结构陶瓷,可用于制造汽车发动机,氮化硅陶瓷的化学式为______。
(2)合理使用药物,保持营养均衡是保证身心健康、提高生活质量的有效手段。
①从中草药中提取的某生物碱,可用于治疗支气管哮喘、鼻黏膜充血引起的鼻塞等。此药物可能是________(填字母)。
a.阿司匹林 b.麻黄碱 c.胃舒平
②饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式________。
③维生素C是一种水溶性维生素。请从提供的药品中选出合适的试剂,写出检验维生素C溶液具有还原性的实验方法和现象:_________________________________(可选药品:石蕊试液、FeCl3溶液、KSCN溶液、淀粉溶液)。
(3)资源节约和环境友好,已成为社会和谐发展的主题。
①以煤炭为主的能源结构易导致酸雨的形成,形成这类酸雨的主要物质是________。燃煤排放的烟气中还含有其他污染物,请列举一种:________。
②居室装修所使用的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质名称是________。
③水中的重金属污染物可通过水中食物链被富集,也可在微生物作用下转化为毒性更大的有机化合物,如:HgCl2+CH4===CH3HgCl+________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与可持续发展密切相关。下列说法正确的是( )
A.直接开采的化石燃料完全燃烧不会造成大气污染
B.从海洋中开采的“可燃冰”释放出的气体与天然气成分相同
C.二氧化碳、水通过人工光合作用生成有机物同时放出能量
D.“干热岩体”(温度大于200℃高温岩体)能源属于化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
请回答:
(1)A的组成元素为(用化学符号表示),化学式为;
(2)C溶液可溶解铜片,例举该反应的一个实际应用;
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518gL﹣1),该气体分子的电子式为 , 写出该反应的离子方程式;
(4)写出F→G反应的化学方程式,设计实验方案探究溶液G中的主要微粒(不考虑H2O,H+ , K+ , I﹣) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,用元素符号或化学用语回答下列问题.
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ||||||
3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
4 | ② | ⑨ |
(1)10种元素中,化学性质最不活泼的是 , 除⑩外原子半径最大的是
(2)①、②、④、⑧四种元素形成的离子半径由大到小的顺序为
(3)⑥和高价态的⑤形成的化合物的电子式是 , ①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为;用电子式表示元素③和⑨形成化合物的过程
(4)⑥、⑦两种元素形成的简单氢化物中,沸点高的是 , 原因是
(5)④和⑧两种元素最高价氧化物对应水化物相互反应的离子方程式
(6)写出一个能表示⑦、⑧两种元素非金属性强弱关系的化学方程式
(7)下列叙述中,肯定a金属比b金属活泼性强的是(填序号)
A.a原子的最外层电子数比b原子的最外层电子数少
B.a原子的电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com