
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示:
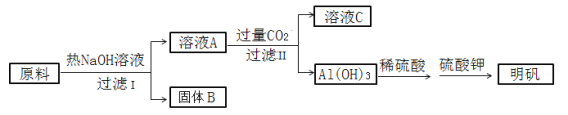
回答下列问题:
(1)原料溶解过程中反应的离子方程式是_________________________。
(2)Al(OH)3 与稀硫酸反应的离子方程式是________________________。
(3)溶液A中通入过量CO2,反应的离子方程式是_________________。
(4)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,并加入_________和________试剂后,溶液立即变红,即证明固体B中含有铁,该过程中铁元素发生的氧化还原反应的离子方程式为_______________。
【答案】![]()
![]()
![]() KSCN溶液 氯水
KSCN溶液 氯水 ![]() 、
、![]()
【解析】
废旧易拉罐碎屑的主要成分为Al,含有少量的Fe、Mg杂质,铝与热氢氧化钠溶液反应生成偏铝酸钠和氢气,过滤后得到溶液A为偏铝酸钠溶液,固体B为Fe、Mg;溶液A中通入过量二氧化碳后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶液C)和氢氧化铝;氢氧化铝与稀硫酸反应生成硫酸铝,硫酸铝与硫酸钾加热可以得到明矾[KAl(SO4)212H2O],据此进行解答。
(1)原料溶解过程中,铝与热氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是![]() 。
。
(2)Al(OH)3 与稀硫酸反应生成硫酸铝和水,反应的离子方程式是![]() ;
;
(3)溶液A是偏铝酸钠,通入过量二氧化碳后生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式是![]() ;
;
(4)固体B加入稀硫酸,铁和硫酸反应生成硫酸亚铁和氢气,向溶液中KSCN溶液后不变色,再加入氯水溶液立即变红,证明反应后溶液中含有亚铁离子,则固体B中含有铁,该过程中铁元素发生的氧化还原反应的离子方程式为![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】反应![]()
![]() ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等
键的数目相等
D.容器内气体的浓度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为石油裂解的主要产物,相对分子质量为28。B为气体,在标准状况下的密度为1.965g·L-1。D与F互为同分异构体,F是环状化合物。G的结构简式为:![]() 。在一定条件下,它们有如图所示的转化关系。
。在一定条件下,它们有如图所示的转化关系。
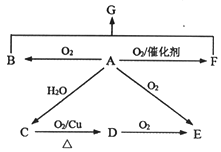
请回答:
(1)E中所含官能团名称________。
(2)B与F反应生成G的反应类型________。
(3)C→D的化学方程式________。
(4)下列说法正确的是________。(填编号)
A.A与O2在催化剂作用下反应也可以生成D B.不可以用金属钠检验C中是否含有少量水
C.可以用NaHCO3溶液鉴别C、D、E的水溶液 D.G可以在NaOH溶液或稀硫酸中发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等.一种利用泥磷(含
(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等.一种利用泥磷(含![]() 和少量
和少量![]() 、
、![]() 、
、![]() 、
、![]() 等)为原料制备
等)为原料制备![]() 的工艺流程如下:
的工艺流程如下:
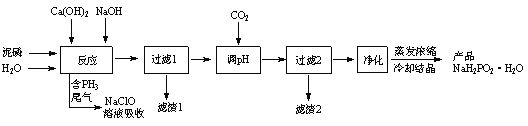
已知:①![]() 与两种碱的反应主要有:
与两种碱的反应主要有:
I.![]()
II.![]()
III.![]()
②2.实验温度下,![]()
![]()
(1)已知![]() 是一元中强酸,写出
是一元中强酸,写出![]() 溶液中存在的所有平衡方程式:_________。
溶液中存在的所有平衡方程式:_________。
(2)通![]() “调
“调![]() ”时,写出除去溶液中
”时,写出除去溶液中![]() 杂质的离子方程式是_________。
杂质的离子方程式是_________。
(3)“过滤2”的滤渣2主要成分为_________(填化学式),“净化”除去![]() 及
及![]() 等时还须用到
等时还须用到![]() 、
、![]() 及
及![]() 溶液,当加入一定量的
溶液,当加入一定量的![]() 溶液后,静置,溶液中
溶液后,静置,溶液中![]() ,则此时溶液中
,则此时溶液中![]() 的浓度为_________
的浓度为_________![]() 。
。
(4)尾气中的![]() 被
被![]() 溶液吸收生成
溶液吸收生成![]() ,则该吸收反应中氧化产物与还原产物的物质的量之比为_________。从吸收液中经结晶、过滤、洗涤、干燥,也可获得产品
,则该吸收反应中氧化产物与还原产物的物质的量之比为_________。从吸收液中经结晶、过滤、洗涤、干燥,也可获得产品![]() ,洗涤该产品常用乙醇,其原因是_________。
,洗涤该产品常用乙醇,其原因是_________。
(5)次磷酸钠的磷元素易被强氧化剂氧化成最高价。实验室可用滴定法测定产品纯度。
甲同学准确称取![]() 产品配成
产品配成![]() 溶液准确量取
溶液准确量取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 酸性
酸性![]() 标准溶液经规范、严密的多次平行滴定,平均消耗酸性
标准溶液经规范、严密的多次平行滴定,平均消耗酸性![]() 溶液
溶液![]() ,则测得产品的纯度为_________,乙同学认为甲同学的测定结果不科学,分析导致甲同学得出如此测定结果的最可能原因是_________。
,则测得产品的纯度为_________,乙同学认为甲同学的测定结果不科学,分析导致甲同学得出如此测定结果的最可能原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
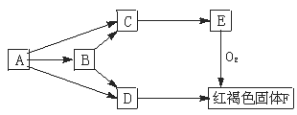
请写出:
(1)B→C+D的离子方程_______________________;
(2)E→F化学方程式__________________________。
(3)若A→B过程的反应不是化合反应,该反应可能的化学方程式___________________。
(4)D通过化合反应转化为C的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com