
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)科学家常用量热剂来直接测定某一反应的反应热,现测得: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式:___________________________。
【答案】 b 放热 AB 0.15mol/(L·min) 12 正反应方向 CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H= - 280.9KJ/mol
【解析】(1)反应物的总能量大于生成物的总能量,该反应正反应放热反应,在催化剂的作用下,降低了反应的活化能,加快反应速率,但是反应的热效应不变;正确答案:b;放热;
(2)从图像看出,起始充入的CO为的浓度为1 mol/L ,容器体积为2L ,CO的物质的量2 mol, A错误; 两种物质参加反应,增加CO浓度,CO的转化率减少,B错误;该反应为反应前后气体总量n≠0的反应,当容器中压强恒定时,反应已达平衡状态,C正确;保可持温度和密闭容器容积不变,再充入1molCO和2molH2,同比例增加反应物,相当于加压过程,平衡向右移动,n(CH3OH)增大,n(CO)减少,达到平衡时,n(CH3OH)/n(CO) 增大,D正确;正确答案选项:A B;
(3)从反应开始到建立平衡,c(CO)减少了0.75 mol/L,v(CO)=0.075 mol/(L·min);根据速率之比与系数成正比关系,v(H2)= 0.15mol/(L·min);由题意可知:反应开始时,c(CO)=1 mol/L,c(H2)=2 mol/L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度 1 2 0
变化浓度 0.75 1.5 0.75
平衡浓度 0.25 0.5 0.75
根据平衡常数计算公式:c(CH3OH)/c(CO)c2(H2)=( 0.75)/ (0.5)2(0.25)= 12;
若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此时各物质的总量变为:1 mol CO,2 molH2,3 molCH3OH;各物质浓度变为:0.5 mol/L CO,1 mol/L H2,1.5 mol/LCH3OH;带入浓度商计算公式:c(CH3OH)/c(CO)c2(H2)=(1.5)/0.5×12=3<12,
平衡向正反应方向;正确答案:0.15mol/(L·min) ; 12 正反应方向;
(4)CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,① ,H2O(l)=H2O(g)△H=+44 kJ/mol,②,用①-②×2:CH3OH(g)+3/2 O2(g)= CO2(g)+ 2H2O(l)△H=-280.9 kJ/mol,32gCH3OH(g)正好为1 mol;
正确答案:CH3OH(g)+3/2 O2(g) = CO2(g)+2 H2O(l) △H= - 280.9KJ/mol;


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2
B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2
D.H2、HCl、HBr、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制硝基苯,正确的操作是( )
A.将苯和硝酸混合,再加入浓硫酸,冷却B.在浓硝酸中加入浓硫酸,冷却后加入苯
C.先加苯,再加浓硫酸,最后加入浓硝酸D.在浓硫酸中加入浓硝酸,冷却后加入苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态化合物X含C,H,O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定X的分子式,所需的最少条件是 ( )
A.①③⑤B.②③④C.①②④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是( )
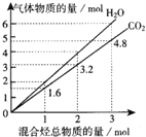
A. 该混合气体一定含有乙烯
B. 该混合气体一定含甲烷和乙炔
C. 在常温下,该混合气体与足量氧气混合,完全燃烧后恢复至常温燃烧前后总体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:

回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com