
【题目】a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2
B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2
D.H2、HCl、HBr、Cl2
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )
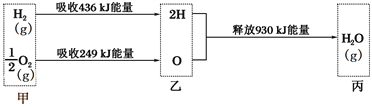
A. H2O分解为H2与O2时放出热量
B. 热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
C. 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D. 乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
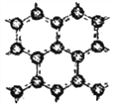
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
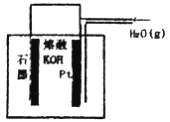
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。

根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中.
(1)除去Ca(OH)2溶液中悬浮的CaCO3 ______;
(2)从碘水中提取碘______;
(3)用自来水制取蒸馏水______;
(4)分离植物油和水______;
(5)与海水晒盐原理相符的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
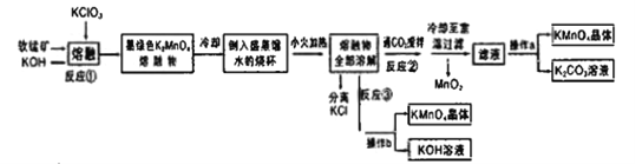
已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1)反应①的化学方程式为______。加热软锰矿、KClO3、和KOH固体时,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有_____,不采用瓷坩埚而选用铁坩埚的理由是________。
(2)反应②中氧化产物与还原产物的物质的量之比为________;上述流程中可以循环利用的物质是__________
(3)实验时,从滤液中得到KMnO4晶体的实验操作a为_____。若CO2过量会生成KHCO3导致得到的KMnO4产品的纯度降低其原因是_________
(4)反应③是模拟工业上采用惰性电极电解法制取高锰酸钾晶体,写出反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组CH3COOH、CH3COONa的混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )

A. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L
B. pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
C. W点所表示的溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、1molH2、1.5molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)科学家常用量热剂来直接测定某一反应的反应热,现测得: CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com