
����Ŀ��FeCl2���ж��е���ɫ������������ӡȾ����ֽ��ҵ����ˮ������FeCl3�ڼ�����������ˮ����ˮ�⡣FeCl3��FeCl2��������C6H5Cl��C6H4Cl2�������ش��������⣺
(1)��FeCl36H2O�Ƶø���FeCl2�Ĺ������£�
i.��ʢ��FeCl36H2O�������м������SOCl2(Һ�壬��ˮ��)�����ȣ������ˮFeCl3��
ii.����ˮFeCl3���ڷ�Ӧ���У�ͨ��һ��ʱ�����������ȣ�����FeCl2��
��FeCl36H2O�м���SOCl2�����ˮFeCl3�Ļ�ѧ����ʽΪ________��(��֪�÷�ӦΪ��������ԭ��Ӧ)
�� ii��ͨ��һ��ʱ����������ټ��ȵ�Ŀ����__________��
(2)���÷�Ӧ2FeCl3 + C6H5Cl![]() 2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)
2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)

������B�������� _____����Ӧǰ����A��ͨ��N2��Ŀ����________��
�ڷ�Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ�������____��____������õ�FeCl2�ֲ�Ʒ��
�۸�װ�ô��ڵIJ���֮����__________��
(3)FeCl2�Ĵ��Ȳⶨ��
��ȡa g��Ʒ���Ƴ�100 mL��Һ��������Һ����ȡ������Һ5.00mL������500 mL��ƿ�ڲ���ˮ200mL������������ƿ�м�����������Һ20.00 mL����0.1 molL-1����KMnO4����Һ�ζ����յ�ʱ��������KMnO4����ҺV mL���ζ����յ���ж�������______________����������Һ����(FeCl2)=kV(VΪ���ĵ����Ը�����ر���Һ�ĺ�����)g��L-1��k=____��
���𰸡�FeCl36H2O��6SOCl2![]() FeCl3+ 12HCl����6SO2�� �ž�װ���ڵĿ�������ֹ����ʱ������ը ������ �ž�װ���ڵĿ�������ֹ���ɵ�FeCl2������ ���� ϴ�� װ��B(��A)��C֮��ȱ��һ��װ����ˮ�Ȼ���(P2O5��轺)�����θ���� ���������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ��30s�ڲ���ɫ 12.7
FeCl3+ 12HCl����6SO2�� �ž�װ���ڵĿ�������ֹ����ʱ������ը ������ �ž�װ���ڵĿ�������ֹ���ɵ�FeCl2������ ���� ϴ�� װ��B(��A)��C֮��ȱ��һ��װ����ˮ�Ȼ���(P2O5��轺)�����θ���� ���������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ��30s�ڲ���ɫ 12.7
��������
(1)��SOCl2��ˮ��Ӧ��������Ͷ�������ͨ�����������ų�װ���ڵĿ������ݴ˷������
(2)��BΪ���������ܣ��Ȼ��������ױ�������������Һ�õ����壬Ӧ���й��ˡ�ϴ�ӵȲ��������Ʊ��Ȼ�����Ӧ����ˮ�⣬�ݴ˷������
(3)�õζ������з��������ӷ���ʽΪ5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O������������ɫ�ı仯�жϵζ��յ㣻5mL�Ȼ�������Һ��n(FeCl2)=5��10-4Vmol���ݴ˼���1L�Ȼ�������Һ�к����Ȼ������������ٽ����(FeCl2)=kV����k��
(1)����ʢ��FeCl36H2O�������м���SOCl2�����Ⱥ����˷�Ӧ��6SOCl2+FeCl36H2O ![]() FeCl3+12HCl��+6SO2������Ӧ���������Ȼ��⣬�����������ӵ�ˮ�⣬�ʴ�Ϊ��6SOCl2+FeCl36H2O
FeCl3+12HCl��+6SO2������Ӧ���������Ȼ��⣬�����������ӵ�ˮ�⣬�ʴ�Ϊ��6SOCl2+FeCl36H2O ![]() FeCl3+12HCl��+6SO2����
FeCl3+12HCl��+6SO2����
��ͨ�����������ų�װ���ڵĿ������������ʱ������ը���ʴ�Ϊ���ž�װ���ڵĿ�������ֹ����ʱ������ը��
(2)������BΪ���������ܣ���Ӧǰ����A��ͨ��N2���ɱ����Ȼ��������������ʴ�Ϊ�����������ܣ��ž�װ���ڵĿ�������ֹ���ɵ��Ȼ�������������
������Һ�õ����壬Ӧ���й��ˡ�ϴ�ӵȲ������ʴ�Ϊ�����ˣ�ϴ�ӣ�
���Ʊ��Ȼ�����Ӧ�����Ȼ���ˮ�⣬Ӧ��װ��B(��A)��C֮���һ����ˮ�Ȼ��Ƶ����θ���ܣ��ʴ�Ϊ��װ��B(��A)��C֮����һ��װ����ˮ�Ȼ��Ƶ����θ���ܣ�
(3)�õζ������з��������ӷ���ʽΪ5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O���ζ��յ㣬��Һ��dz��ɫ���Ұ�����ڲ���ɫ��5mL�Ȼ�������Һ��n(FeCl2)=5��10-4Vmol����1L�Ȼ�������Һ�к����Ȼ�����������Ϊm(FeCl2)=5��10-4V��200��127=12.7Vg������(FeCl2)=kVg/L=12.7Vg/L�����k=12.7���ʴ�Ϊ�����������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ���Ұ�����ڲ���ɫ��12.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ����������ء�����˵��������ǣ� ��
A.��˿������Ȼ�߷��Ӳ���
B.������¼Ƭ��֮�¡����������DZ���ʮ�����ӻ������⣬�ᳫ��Դ����3R�����ã�����������Դ���ģ�Reduce)��������Դ���ظ�ʹ�ã�Reuse���������Դ��ѭ�����ã�Recycle��
C.��ʯȼ����ȫȼ�ղ�����ɴ�����Ⱦ
D.�й��Ŵ���������Һ��ϴͭ�������ͭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�е�̼���ƺ�ˮ����ȫ��Ӧ��CaC2+2H2O=C2H2��+Ca(OH)2ʹ��Ӧ������������ˮ�������ų�ˮ��������ɼ������״������Ȳ��������Ӷ��ɲⶨ��ʯ��̼���Ƶĺ�����
��1���������������͵�����װʵ��װ��

����������������������ʱ�����������͵��ܴ�����ֱ�����ӵ�˳��������������ܵ���ţ��ǣ�____��____��____��____��____��____��
��2���������Ӻú���ʵ��ʱ�������в�����ÿ�����ֻ����һ�Σ���
�ٳ�ȡһ������ʯ����������3�У�������Ƥ����
�ڼ��װ�õ������ԡ�
��������6��5��ע������ˮ��
�ܴ�����3�ָ�������ʱ����ȡ����4��ˮ�����������2�е�ˮ���Բ��ƣ���
��������������6�Ļ�����ʹˮ��ε��£�������������ʱ���رջ�����
��ȷ�IJ���˳���ò��������д����__________________��
��3����ʵ�������������������ζ���Ҳⶨ���ƫ��������Ϊ��ʯ�к���___________���ʡ�
��4����ʵ��ʱ��ȡ�ĵ�ʯ1.60g�������ų�ˮ�����������ɱ�״����Ȳ�����Ϊ448mL���˵�ʯ��̼���Ƶ�����������_________%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˾ƥ�֣�������L����������֪�Ľ�����ʹҩ�һ�ֳ�Ч�����Ͱ�˾ƥ�֣�������P����ṹ��ʽΪ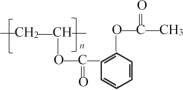 ���ĺϳ�·����ͼ��ʾ��
���ĺϳ�·����ͼ��ʾ��

��֪����HC![]() CH+RCOOH
CH+RCOOH![]()
��RCOOR��+R��OH![]() RCOOR��+R��OH(R��R����R����������)
RCOOR��+R��OH(R��R����R����������)
��1��A�еĹ�������___��
��2��C�Ľṹ��ʽ��___��
��3��D��E�ķ�Ӧ������___��
��4��E��G�Ļ�ѧ����ʽ___��
��5����֪��H�Ƿ����廯���L�����ڿɽϿ�ת��Ϊ����ҩЧ��J����������P��L��ȣ��������ܻ��������ͷ�J��
��ѪҺ��JŨ�ȹ�����ʹ���ж����ɾ�����עNaHCO3��Һ�ⶾ�����û�ѧ����ʽ����NaHCO3������___��
��д��J��L�Ļ�ѧ����ʽ___���˷�Ӧ�ĸ���Ӧ��J�����������ۣ�д��������Ľṹ��ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
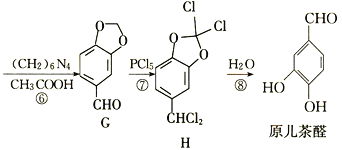
����Ŀ��ԭ����ȩ��һ��ҽҩ�м��壬һ�ֺϳ�·����ͼ��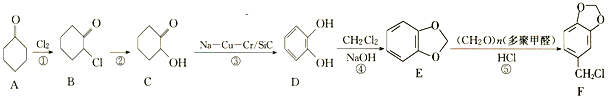
�ش��������⣺
(1)A�еĹ�����������________��
(2)̼ԭ��������4����ͬ��ԭ�ӻ����ʱ����̼��Ϊ����̼��B��____(������������û����)����̼��
(3)��Ӧ�ٵ�������__________����Ӧ�������Լ��������ֱ�Ϊ________��
(4)ԭ����ȩ�ķ���ʽΪ________��
(5)W��C��Ϊͬ���칹�壬W�в�����״�ṹ���ܷ���ˮ�ⷴӦ���˴Ź�������ֻ��3����ҷ����֮��Ϊ6��3��1��W�Ľṹ��ʽΪ_________(ֻдһ��)��
(6)����Ա��Ӻ�(CH2O)nΪԭ���Ʊ�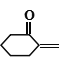 �ĺϳ�·��_______��(���Լ���ѡ)����֪�������ڶ�ۼ�ȩ���Ȼ��������£�����λ����ȡ����Ӧ��
�ĺϳ�·��_______��(���Լ���ѡ)����֪�������ڶ�ۼ�ȩ���Ȼ��������£�����λ����ȡ����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������������ȷ����
A.0.5 mol Mg�ڿ�������ȫȼ������MgO��Mg3N2ʱ��ת�Ƶĵ�����ΪNA
B.7.8 g Na2O2������ˮ��Ӧʱ��ת�Ƶĵ�����Ϊ0.2NA
C.64 g CaC2��������������������������Ϊ3NA
D.�ܱ������г���1 mol H2��1 mol I2��Ӧ�Ʊ�HIʱ������H-I������ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������нϹ㷺�Ŀ������ã���ṹ��ʽ����ͼ��ʾ��

���ڿ������������������ȷ����(����)
A������ʽΪC16H13O9
B��1 mol����������뺬8 mol NaOH����Һ��Ӧ
C����ʹ����KMnO4��Һ��ɫ��˵�����ӽṹ�к���̼̼˫��
D����Ũ��ˮ�ܷ����������͵ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���о���ͭ���Ϸ��ϣ������ڣ�����Ag2S�����������ʼ��Ʊ�����ͭ���壬�������� :�������е��������������ϵͣ���ʵ��Ӱ��ɺ��ԣ�

��֪���� AgCl�����ڰ�ˮ������[Ag(NH3)2]+��
�� Ksp��Ag2SO4��=1.2��10-5��Ksp��AgCl��=1.8��10-10��
�������к��������������������ܣ���
��1������I��Ϊ�˼ӿ�����������ʣ����Բ�ȡ____________��ʩ(д������һ�ּ���)��
��2������IV����_______________��_________________�����ˡ�ϴ�Ӻ�����Եõ�����ͭ���塣
��3��ϴ������II��������ϲ���Ŀ����________________________________��
��4������III�У�NaClO��Һ��Ag��Ӧ�IJ���ΪAgCl��NaOH��NaCl��O2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________������AgCl��NaCl�����ʵ���֮��Ϊ2:1����������ͬʱ��������ת�������ӷ���ʽΪ______________________________����ƽ�ⳣ��K=_____________________�� HNO3Ҳ������Ag���ӷ�Ӧ����ĽǶȷ�������HNO3����NaClO��ȱ����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1 mol/L ������ζ���ͬŨ�ȵ�25 mL�廯�£�N2H5Br����Һ����֪�£�N2H4���Ƕ�Ԫ���N2H4+H2O ![]() N2H5+ + OH- Kb1 = 1.0 �� 10-6��N2H5+ + H2O
N2H5+ + OH- Kb1 = 1.0 �� 10-6��N2H5+ + H2O ![]() N2H62+ + OH- Kb2 = 1.3 �� 10-15���ζ������л����Һ����Ե��������仯������ͼ��ʾ����������������ǣ� ��
N2H62+ + OH- Kb2 = 1.3 �� 10-15���ζ������л����Һ����Ե��������仯������ͼ��ʾ����������������ǣ� ��

A.N2H4�����ᷴӦ�γɵ���ʽ�εĻ�ѧʽΪN2H6��HSO4��2
B.b���ʾ�������廯��ǡ����ȫ��Ӧ��c��Cl-��=c��Br-��>c��N2H62+��
C.a���Ӧ����Һ�У�c��Br-����c��OH-�� �T c��N2H5+����2c��N2H62+����c��H+��
D.c��Ļ����Һ�У�c��Cl-��>c��Br-��>c��H+��>c��N2H62+��>c��N2H5+��>c��OH-��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com