
【题目】乙苯和二氧化碳反应生成苯乙烯的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)( )
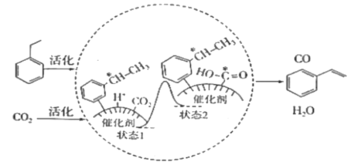
A.10.6g乙苯中所含的极性共价键数目为1.0NA
B.增加二氧化碳的浓度,可能提高苯乙烯的产率
C.状态1到状态2有氧氢键形成
D.标准状况下,10.4g苯乙烯中所含的电子数目为4.0NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
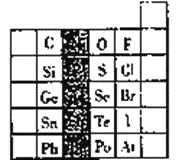
(1)阴影部分元素在元素周期表中的位置为第_________族。根据元素周期律、预测;酸性强弱H3AsO4______H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等合金金属作为主电极,借助外加脉冲高电压作用产生电化学反应,把电能转化为化学能,以牺牲阳极金属电极产生金属阳离子絮凝剂,通过凝聚、浮除、还原和氧化分解将污染物从水体中分离,从而达到净化水体的目的。下列说法正确的是( )
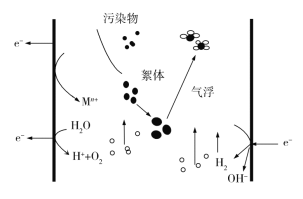
A.右极为阳极,左极为阴极
B.电子从左极经电解液流入右极
C.每产生1 mol O2,整个电解池中理论上转移电子数为4NA
D.若铁为阳极,则在处理废水过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
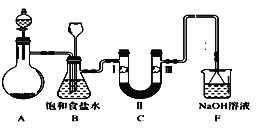
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
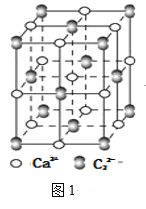
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
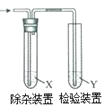
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为![]() ],酸液室通入
],酸液室通入![]() (以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
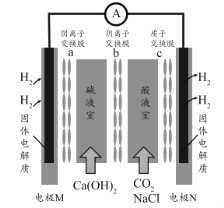
A. 电子由N极经外电路流向M极
B. N电极区的电极反应式为![]() ↑
↑
C. 在碱液室可以生成 ![]()
D. 放电一段时间后,酸液室溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
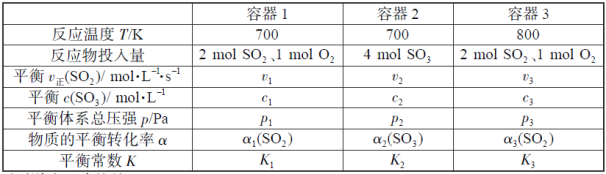
下列说法正确的是
A.v1<v2,c2<2c1B.K1>K3,p2>2p3
C.v1<v3,α1(SO2)<α3(SO2)D.c2>2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com