
����Ŀ���ұ��������Ʊ���ϩ��Ӧ��![]() +H2(g)��
+H2(g)��
��ҵ�ϣ�ͨ�����ұ������в���ˮ����(ԭ�������ұ���ˮ���������ʵ���֮��Ϊ1�U9)�����Ʒ�Ӧ�¶�600�棬��������ϵ��ѹΪ��ѹ�������½��з�Ӧ���ڲ�ͬ��Ӧ�¶��£��ұ���ƽ��ת���ʺ�ij���������±���ϩ��ѡ����(ָ����H2����IJ����б���ϩ�����ʵ�������)ʾ��ͼ��ͼ��
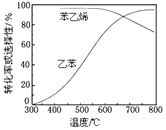
�ٲ���ˮ����������ұ���ƽ��ת���ʣ�����˵������ʵ___��
�ڿ��Ʒ�Ӧ�¶�Ϊ600���������___��
���𰸡�����Ӧ����������������ӣ�����ˮ������ϡ�ͣ��൱�����ѹ��Ч�� 600��ʱ���ұ���ת���ʺͱ���ϩ��ѡ���Ծ��ϸߡ��¶ȹ��ͣ���Ӧ��������ת���ʵͣ��¶ȹ��ߣ�ѡ�����½������»�����ʹ����ʧ����ܺĴ�
��������
�ٱ���ѹǿ���䣬����ˮ������������������൱�ڽ���ѹǿ��ƽ�����������ķ����ƶ���
��600��ʱ�ұ���ת�����뱽��ϩ��ѡ���Խϸߣ�����¶ȶ��ұ�ת���ʡ�����ϩѡ���ԡ��¶ȶԷ�Ӧ�����������Ӱ�켰���������Ƚ��з�����
�ٱ���ѹǿ���䣬����ˮ������������������൱�ڽ���ѹǿ��ƽ�����������ķ����ƶ�������ұ���ת���ʣ�
��600��ʱ�ұ���ת�����뱽��ϩ��ѡ���Խϸߣ��¶ȹ��ͣ���Ӧ���ʽ�����ת���ʽϵͣ��¶ȹ��ߣ�ѡ�����½������¿���ʹ����ʧȥ���ԣ������ĵ��������࣬��˰��¶ȿ�����600�����ҡ�


 �����ÿ�ʱѵ��ϵ�д�
�����ÿ�ʱѵ��ϵ�д� ��Ԫȫ��������ϵ�д�
��Ԫȫ��������ϵ�д� �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ����ľ����ṹ��NaCl���������
����ľ����ṹ��NaCl���������![]() ��ͼ��ʾ
��ͼ��ʾ![]() ������Ϊ
������Ϊ![]() �����к��е�������
�����к��е�������![]() �Ĵ��ڣ�ʹ������һ���������������й���
�Ĵ��ڣ�ʹ������һ���������������й���![]() �����˵������ȷ����
�����˵������ȷ����![]()

A. 1��![]() ��Χ��������ҵȾ����
��Χ��������ҵȾ����![]() ��ĿΪ4
��ĿΪ4
B. �þ����е������Ӻ�O2�ǵȵ�����
C. ![]() ��
��![]() �����������0.2mol
�����������0.2mol
D. ��ÿ��![]() ��������������
��������������![]() ����12��
����12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1�����м��������У���Ϊͬϵ�����______________����Ϊͬ���칹�����______________��
��O2��O3
��35Cl��37Cl
��CH3CH3��CH3CH2CH3
��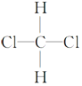 ��
��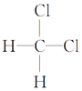
��CH3��CH2��2CH3�ͣ�CH3��2CHCH3
��2������A��ͬ��ͬѹ���������ܶ���H2��43���������ķ���ʽΪ______________������ʽΪC8Hn��ϩ��B��nΪ______________��
��3����Է�������Ϊ58������C�Ľṹ��______________�֣��Էֱ�д�����ǵĽṹ��ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�̲IJ�ͼ���м������ں��ḻ���ص㡣��ش��������⣺
��1���������ڵ�ij����Ԫ�أ����һ�����������������ͼ1��ʾ�����Ԫ�ض�Ӧ��ԭ����_____�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2����ͼ2��ʾ��ÿ�����߱�ʾ���ڱ���A ~��A �е�ijһ��Ԫ���⻯��ķе�仯��ÿ��С�ڵ����һ���⻯�����a���������___________���ж�������____________��
��3��CO2�ڸ��¸�ѹ�����γɵľ����侧����ͼ3��ʾ����þ������������_____________���塣
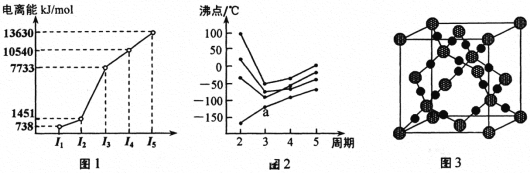
��4����һ�����ܽ���Al��P֮��ĵ�������Ԫ����____�֡� GaCl3������ԭ�ӵ��ӻ���ʽΪ_________��д����GaCl3�ṹ��ͬ��һ�ֵȵ����壨д���ӣ�______________��
��5�������ɱ����ⶼ�Ƿ��Ӿ��壬���Ľṹ���������ԣ����ɱ�����ľ���������ƵĽṹ�������ɱ�������һ��������Χ��__________�����ڷ��ӡ� D�������ξ���ֲ��ṹ��ͼ���þ����к��еĻ�ѧ����_____________������ĸ��ţ���
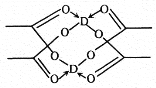
a�����Լ� b���Ǽ��Լ� c����λ�� d��������
��6��Fe��һ�־�����ס�����ʾ�����������߷������ҵõ���A~Dͼ����ȷ����_____������ĸ��ţ���

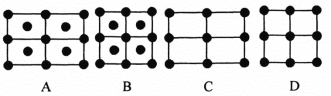
��ԭ�ӵ���λ����____________��������ԭ�ӵİ뾶��r cm���þ�����ܶ�����g/cm3 �����������ԭ������Ϊ________________���谢���ӵ�������ֵΪNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO��g��+2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H2
CH3OH��g��+H2O��g�� ��H2
��CO2��g��+H2��g��![]() CO��g��+H2O��g�� ��H3
CO��g��+H2O��g�� ��H3
�ش��������⣺
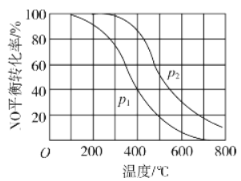
��1����Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ___��ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ___�������߱����ĸ�������ж�������___��
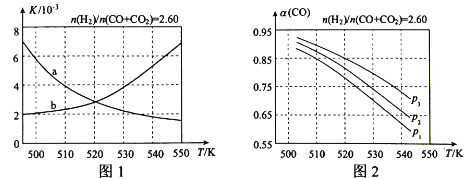
��2���ϳ��������![]() ��2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ������CO��ֵ���¶����߶�___������������������С��������ԭ����___��ͼ2�е�ѹǿ�ɴ�СΪ___�����ж�������___��
��2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ������CO��ֵ���¶����߶�___������������������С��������ԭ����___��ͼ2�е�ѹǿ�ɴ�СΪ___�����ж�������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ������Ӧ������Ч����( )
A.![]() ��ϡ���ᷴӦ��ȡH2ʱ������Ũ����
��ϡ���ᷴӦ��ȡH2ʱ������Ũ����
B.Na��ˮ��Ӧʱ������ˮ������
C.��K2SO4��Һ��BaCl2��Һ��Ӧʱ������ѹǿ
D.���ܱ������н��з�Ӧ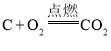 ʱ��ѹ���������������ѹǿ
ʱ��ѹ���������������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��һϵ�з�Ӧ���Եõ�HNO3����ͼ��ʾ��
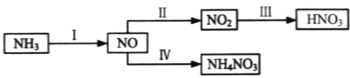
II�У�2NO��g��+O2![]() 2NO2(g)��������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�����¶ȱ仯�����ߣ���ͼ����
2NO2(g)��������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�����¶ȱ仯�����ߣ���ͼ����
�ٱȽ�P1��P2�Ĵ�С��ϵ��___��
�����¶����ߣ��÷�Ӧƽ�ⳣ���仯��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A.��1��CsCl�������1��Cs+
B.SO2��ˮ�е��ܽ�ȱ�CO2��ˮ�е��ܽ��Ҫ��
C.X��YԪ��ͬ���ڣ��ҵ縺��X��Y����һ�����ܿ���Y����X
D.���ݵ����Ų����ص㣬Cu��Ga�����ڱ��ж�����d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܣ�Co����һ����Ҫ��ս�Խ������ܼ���Ͻ�㷺Ӧ���ڵ������е�����������պͺ�����������ڻ�������ͨ����+2��+3����ʽ���ڡ�
��1��д����̬Coԭ�ӵĺ�������Ų�ʽ___________________��
��2��Co2+��Co3+������CN-�γ���λ��Ϊ6�������ӡ�CN-��̼ԭ�ӵ��ӻ���ʽΪ_____��1mol HCN��������������ĿΪ_________��
��3��Co��һ��������ľ�����ͼ��ʾ�����к������Co�������������Ļ�ѧʽΪ_______���ڸþ�������һ�������ӵȾ����������Co�������γɵĿռ乹��Ϊ___________��
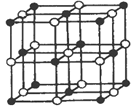
��4����KCN������Co2+������Һ���к�ɫ��Co(CN)2�������������ڹ�����KCN��Һ��������ɫ��[Co(CN)6]4-������������һ���൱ǿ�Ļ�ԭ�����ڼ���ʱ����ˮ��Ӧ����[Co(CN)6]3-��д���÷�Ӧ�����ӷ���ʽ__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com