
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
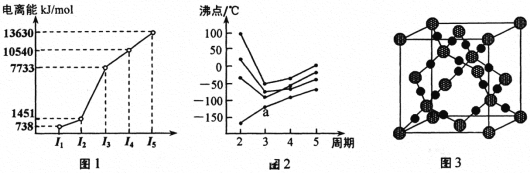
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
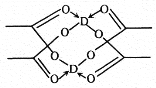
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

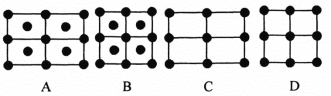
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
【答案】12 SiH4 在ⅣA ~ⅦA中的氢化物里,只有ⅣA族元素氢化物沸点不存在反常现象,且a为第三周期氢化物,故a为SiH4 原子 3 sp2杂化 CO32-、NO3- 12 abc A 8 ![]()
【解析】
综合应用物质结构与性质知识解答,同种元素逐级电离能规律、周期表中第一电离能的周期性规律、分子间氢键对物质沸点的影响、化学键的类型与判断、中心原子的杂化类型、等电子体的概念与书写、分子晶体和金属晶体中配位数的含义、晶胞;边长与密度的计算等。
(1)图1中,I2 与I3相差较大,该元素原子最外层有两个电子,应是第三周期主族元素镁(Mg)。电子的运动状态取决于电子所处的能层、能级、原子轨道和自旋方向,镁原子核外共有12个电子,则有12种不同运动状态的电子。
(2)第ⅣA ~ⅦA元素的氢化物中,NH3、H2O、HF的分子间有氢键,使得它们的沸点与同族其它元素的氢化物相比“反常”。图2中a点所在折线无“反常”,为第IVA元素的氢化物,a点代表的是第三周期的氢化物SiH4。
(3)图3中,C、O原子通过共价键形成空间网状晶体,属于原子晶体。
(4)第IIA族元素np能级全空、第VA族元素np能级半充满,使第一电离能出现“反常”。第三周期元素第一电离能由小到大的顺序为Na、Al、Mg、Si、S、P、Cl、Ar,介于Al、P之间的有Mg、Si、S三种元素。 Ga位于第四周期第IIIA族,GaCl3分子中,Ga原子价层电子对数为(3+1×3)/2=3,则其杂化方式为sp2。要写与GaCl3互为等电子体的离子,应在价电子总数不变的前提下,将Ga、Cl换成它们的邻族元素,如CO32-、NO3-等。
(5)干冰晶胞为面心立方堆积,若考察上表面的面心二氧化碳分子,则它与上表面的四个顶点、前后左右四个面心、以及上面一个晶胞的前后左右四个面心,共12个二氧化碳分子距离最近且相等。 从D的醋酸盐晶体局部结构看,该晶体中有C-H、C-O、C=O、O-D等极性键,有C-C非极性键,有O→D配位键,故选abc。
(6)图甲为该铁的一个晶胞,沿虚线的切面为长方形,长是宽的![]() 倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图。考察图甲体心铁原子,则其配位数为8。设图甲中晶胞边长为a cm,则体对角线为
倍,四个顶角和中心有铁原子。图乙为8个晶胞叠成的立方体,沿虚线的切面为A图。考察图甲体心铁原子,则其配位数为8。设图甲中晶胞边长为a cm,则体对角线为![]() a cm。又体对角线上三原子相切,得
a cm。又体对角线上三原子相切,得![]() a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=
a cm=4r cm。根据密度和铁原子数求得的一个晶胞质量相等,有ρg/cm3×(a cm)3=![]() ,解得M(Fe)=
,解得M(Fe)=![]() g/mol,Mr(Fe)=
g/mol,Mr(Fe)=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为___。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因___。
(3)与SeO3互为等电子体的两种阴离子___(写化学式)。
(4)AsF3是极性分子,理由是___。
(5)金刚砂(SiC)晶胞如图所示:
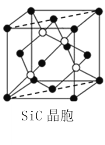
①金刚砂中硅原子的杂化轨道类型为___,沿晶胞图中虚线方向的切面图为___(填标号)。
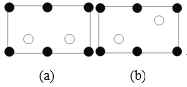
②若晶胞参数为apm,阿伏加德罗常数为NA,则金刚砂的密度为___g·cm-3(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同。
阴离子 | Cl-、SiO32-、OH-、NO3- |
阳离子 | H+、Ag+、Na+、K+ |
已知:A溶液呈强酸性,且A溶液与B、C溶液混合均产生白色沉淀,B的焰色反应呈黄色。
回答下列问题:
(1)写出A、B、C、D的化学式:A______,B_____,C____,D____。
(2)写出A溶液与B溶液反应的离子方程式: __________。
(3)请选出适合存放A、C、D溶液的试剂瓶的序号:

溶液 | A | C | D |
试剂瓶序号 | ___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol/L的HX溶液、HY溶液中分别滴加0.1mol/L的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加NaOH溶液体积的关系如图所示。下列推断正确的是
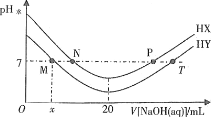
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都一定降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首架国产大飞机C919采用的先进材料主要有第三代铝锂合金、碳纤维复合材料及钛合金等。回答下列问题:
![]() 基态原子核外电子排布式为______,其核外电子占据最高能层的符号是______。
基态原子核外电子排布式为______,其核外电子占据最高能层的符号是______。
![]() 电子结合能是指在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值。Li的2s轨道电子结合能比1s轨道的______
电子结合能是指在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值。Li的2s轨道电子结合能比1s轨道的______![]() 填“大”或“小”
填“大”或“小”![]() ,原因是______。
,原因是______。
![]() 基碳纤维是以聚丙烯腈纤维为原料的碳纤维。丙烯腈
基碳纤维是以聚丙烯腈纤维为原料的碳纤维。丙烯腈![]() 分子中
分子中![]() 键和
键和![]() 键的个数比为______,碳原子间共价键的键角约为______。
键的个数比为______,碳原子间共价键的键角约为______。
![]() 工业上用镁还原
工业上用镁还原![]() 的方法制备金属钛,元素Mg、Ti、Cl的电负性分别为
的方法制备金属钛,元素Mg、Ti、Cl的电负性分别为![]() 、
、![]() 、
、![]() ,
,![]() 的熔点______
的熔点______![]() 的熔点
的熔点![]() 填“高于”或“低于”
填“高于”或“低于”![]() 。
。
![]() 钛存在两种同素异构体,
钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用______法,由
采纳体心立方堆积,鉴别两种钛晶体可以用______法,由![]() 转变为
转变为![]() 晶体体积______
晶体体积______![]() 填“膨胀”或“收缩”
填“膨胀”或“收缩”![]() 。
。
![]() 由Ba、Ti和O组成的三元离子晶体中,晶胞的顶点被
由Ba、Ti和O组成的三元离子晶体中,晶胞的顶点被![]() 占据,体心被
占据,体心被![]() 占据,面心被
占据,面心被![]() 占据,晶胞参数
占据,晶胞参数![]() ,该晶体的化学式为______。
,该晶体的化学式为______。![]() 为140pm,则
为140pm,则![]() 为______
为______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于CO2和CO32-的下列说法正确的是 ( )
A.两种微粒的中心原子均无孤电子对B.两种微粒价层电子对数相同
C.键角:CO32-> CO2D.两种微粒的中心原子杂化方式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是锂 ②形成的离子中,氧化性最强的是锂离子 ③在自然界中均以化合态形式存在 ④Na在空气中久置后,成分为Na2CO3 ⑤均可与水反应,产物均为MOH和H2 ⑥它们在O2中燃烧的产物都有M2O和M2O2两种形式 ⑦粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③④⑤B.③④⑤⑥⑦C.①②④⑥⑦D.②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L 氟化氢所含分子数为0.1NA
B.常温下,22.4 L 氯气与足量镁粉充分反应,转移的电子数为 2NA
C.丙烯和环丙烷组成的 42 g 混合气体分子中共用电子对总数为 9NA
D.化学反应中每生成 1 mol O2,转移的电子数为 4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com