
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为___。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因___。
(3)与SeO3互为等电子体的两种阴离子___(写化学式)。
(4)AsF3是极性分子,理由是___。
(5)金刚砂(SiC)晶胞如图所示:
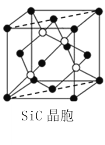
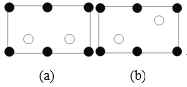
①金刚砂中硅原子的杂化轨道类型为___,沿晶胞图中虚线方向的切面图为___(填标号)。
②若晶胞参数为apm,阿伏加德罗常数为NA,则金刚砂的密度为___g·cm-3(列出表达式)。
【答案】[Ar]3d104s24p1 Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构 CO32-、NO3- 分子中正、负电荷中心不重合 sp3 a ![]()
【解析】
(1)Ga为31号元素,基态Ga原子核外有31个电子,基态Ga原子的电子排布式为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;
(2)Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构,所以在高温下CuO能分解生成Cu2O;
(3)等电子体原子个数相同,价电子数相同,SeO3原子个数为4,价电子个数为24,与之互为等电子体的阴离子有CO32-、NO3-等;
(4)AsF3中新原子价层电子对数为3+![]() =4,含1对孤对电子,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子;
=4,含1对孤对电子,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子;
(5)①金刚砂中硅原子形成4个Si-C键,Si原子杂化轨道数目为4,Si原子采取sp3杂化。切面为长方形,面对角线上3个黑色球共线,面对角线为长方形的长,棱为长方形的宽,内部下方的2个白色球处于切面上,且到晶胞下底面虚线距离相等,图中(a)符合;
②晶胞中白色球数目为4、黑球数目为![]() ,故晶胞中Si、C原子数目均为4个,晶胞质量m=
,故晶胞中Si、C原子数目均为4个,晶胞质量m=![]() ,晶胞体积V=a3pm3=(a×10-10)cm3,所以晶胞的密度为
,晶胞体积V=a3pm3=(a×10-10)cm3,所以晶胞的密度为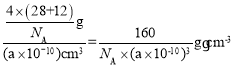 。
。


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜
、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜![]() 含杂质
含杂质![]() 为原料,一种制备铜的氯化物的流程如下:
为原料,一种制备铜的氯化物的流程如下:

(1)上述流程中固体K溶于稀盐酸的目的是 ______ ![]() 试剂X、固体J的物质分别为 ______ .
试剂X、固体J的物质分别为 ______ .
A.NaOH![]() B.CuO
B.CuO![]() C.
C.![]()
![]()
![]()
![]()
(2)反应②是向溶液2中通入一定量的![]() ,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):_________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
素材1:某温度和压强下,2L容器中,发生反应2SO2+O2![]() 2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:
2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:

素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)

根据以上的两个素材回答问题:
(3)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为________。
(4)根据素材2中分析得到,提高该化学反应限度的途径有_______________。
(5)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应具体条件是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种金属单质和甲、乙、丙三种气体,及物质D、E、F、G、H,它们之间能发生如图所示变化(图中有些反应的产物和反应的条件没有全部标出)。请回答下列问题:

(1)写出指定物质的化学式:D____________、G____________、丙____________。
(2)上述反应中既是化合反应,又是氧化还原反应的是____________(填序号)。
(3)写出反应①的离子方程式:____________________________________。
(4)写出反应⑤的离子方程式________________________。用于检验溶液G中金属阳离子的试剂是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
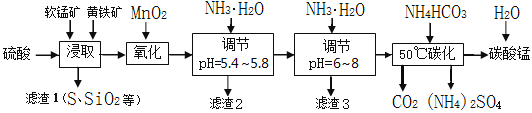
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:

已知:![]()

回答下列问题:
(1)B的结构简式为_________;E中官能团的名称为_________。
(2)1mol D与足量氢氧化钠反应,最多可以消耗氢氧化钠的物质的量为_______mol。
(3)下列有关说法正确的是____________。
A.用高锰酸钾溶液可以鉴别B和C
B.D含有3个官能团
C.等物质的量的A和C完全燃烧的耗氧量一样多
D.M可以发生的反应类型有:取代、加成、氧化、水解、酯化
(4)由F生成M的化学方程式为___________________________________。
(5)E有多种同分异构体,同时满足下列条件的同分异构体有________种。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)参照上述合成路线和信息,以乙烯和乙醛为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备聚
,设计制备聚![]() 丁烯的合成路线_______________。
丁烯的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d四种短周期主族元素,在周期表中相对位置如图,下列说法正确的是
A. a、c两元素的最高正价一定相等
B. 原子半径大小顺序为:c>d>b>a
C. a、b两元素可能形成多种共价化合物
D. c、d二种元素气态氢化物的稳定性比较:c > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
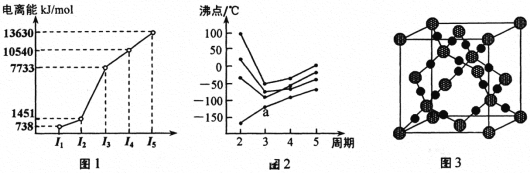
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

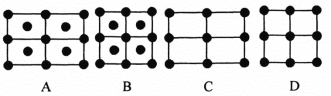
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com