
【题目】我国首架国产大飞机C919采用的先进材料主要有第三代铝锂合金、碳纤维复合材料及钛合金等。回答下列问题:
![]() 基态原子核外电子排布式为______,其核外电子占据最高能层的符号是______。
基态原子核外电子排布式为______,其核外电子占据最高能层的符号是______。
![]() 电子结合能是指在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值。Li的2s轨道电子结合能比1s轨道的______
电子结合能是指在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值。Li的2s轨道电子结合能比1s轨道的______![]() 填“大”或“小”
填“大”或“小”![]() ,原因是______。
,原因是______。
![]() 基碳纤维是以聚丙烯腈纤维为原料的碳纤维。丙烯腈
基碳纤维是以聚丙烯腈纤维为原料的碳纤维。丙烯腈![]() 分子中
分子中![]() 键和
键和![]() 键的个数比为______,碳原子间共价键的键角约为______。
键的个数比为______,碳原子间共价键的键角约为______。
![]() 工业上用镁还原
工业上用镁还原![]() 的方法制备金属钛,元素Mg、Ti、Cl的电负性分别为
的方法制备金属钛,元素Mg、Ti、Cl的电负性分别为![]() 、
、![]() 、
、![]() ,
,![]() 的熔点______
的熔点______![]() 的熔点
的熔点![]() 填“高于”或“低于”
填“高于”或“低于”![]() 。
。
![]() 钛存在两种同素异构体,
钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用______法,由
采纳体心立方堆积,鉴别两种钛晶体可以用______法,由![]() 转变为
转变为![]() 晶体体积______
晶体体积______![]() 填“膨胀”或“收缩”
填“膨胀”或“收缩”![]() 。
。
![]() 由Ba、Ti和O组成的三元离子晶体中,晶胞的顶点被
由Ba、Ti和O组成的三元离子晶体中,晶胞的顶点被![]() 占据,体心被
占据,体心被![]() 占据,面心被
占据,面心被![]() 占据,晶胞参数
占据,晶胞参数![]() ,该晶体的化学式为______。
,该晶体的化学式为______。![]() 为140pm,则
为140pm,则![]() 为______
为______![]()
【答案】![]() N 大 2s轨道上的电子离核远,能量高,电离时需要的能量少 2:1 120° 高于 X—射线衍射法 膨胀
N 大 2s轨道上的电子离核远,能量高,电离时需要的能量少 2:1 120° 高于 X—射线衍射法 膨胀 ![]()
![]()
【解析】
(1)Ti为22号元素,根据构造原理书写其电子排布式;因其核外电子所处最高能层为第四层,故最高能层符号为N;
(2)从电子结合能概念角度分析Li的2s轨道电子结合能与1s轨道结合能大小关系,重点理解电子结合能取负值;
(3)从丙烯腈分子的结构式分析,判断其σ键数目和π键数目,碳原子间共价键的键角需要分析中间C原子的杂化方式;
(4)元素Mg、Ti、Cl的电负性分别为![]() 、
、![]() 、
、![]() ,由此可知,Mg、Cl的电负性差值大于1.7,
,由此可知,Mg、Cl的电负性差值大于1.7,![]() 为离子晶体,Ti、Cl的电负性差值小于1.7,
为离子晶体,Ti、Cl的电负性差值小于1.7,![]() 为分子晶体;
为分子晶体;
(5)鉴别晶体堆积方式常用方法是X射线衍射法,αTi采纳六方最密堆积,βTi采纳体心立方堆积,由于六方最密堆积空间利用率大于体心立方堆积,故由αTi转化为βTi晶体体积膨胀;
(6)根据均摊法,计算得到晶体的化学式为BaTiO3,在该晶胞中Ba2+处在顶点位置,O2处在面心位置,面对角线长度![]() 等于2倍r(Ba2+)加上2倍r(O2),即可求出r(Ba2+)。
等于2倍r(Ba2+)加上2倍r(O2),即可求出r(Ba2+)。
![]() 为22号元素,Ti的基态原子核外电子排布式为
为22号元素,Ti的基态原子核外电子排布式为![]() ,最高能层符号为N;
,最高能层符号为N;
故答案为:![]() ;N;
;N;
![]() 电子结合能指的是在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值,这里注意是所需能量的负值。因为Li的2s轨道上的电子离原子核比较远,能量较高,电离时需要的能量少,故2s轨道电子结合能比1s轨道的大;
电子结合能指的是在中性原子中当其他电子均处在可能的最低能态时,某电子从指定的轨道上电离时所需能量的负值,这里注意是所需能量的负值。因为Li的2s轨道上的电子离原子核比较远,能量较高,电离时需要的能量少,故2s轨道电子结合能比1s轨道的大;
故答案为:大;2s轨道上的电子离核远,能量高,电离时需要的能量少;
(3)1个丙烯腈分子中有3个C—H键、1个C=C键、1个C—C键、1个C≡N键,单键全为σ键,双键中含1个σ键和1个π键,三键中含1个σ键和2个π键,1个丙烯腈分子中含6个![]() 键和3个
键和3个![]() 键,中间的C原子采取
键,中间的C原子采取![]() 杂化,故键角为
杂化,故键角为![]() ;故答案为:2:1;
;故答案为:2:1;![]() ;
;
![]() 元素Mg、Ti、Cl的电负性分别为
元素Mg、Ti、Cl的电负性分别为![]() 、
、![]() 、
、![]() ,Cl与Mg的电负性差值为1.8>1.7,
,Cl与Mg的电负性差值为1.8>1.7,![]() 为离子晶体,Cl与Ti的电负性差值为1.5<1.7,
为离子晶体,Cl与Ti的电负性差值为1.5<1.7,![]() 为分子晶体,则
为分子晶体,则![]() 的熔点高于
的熔点高于![]() 的熔点;
的熔点;
故答案为:高于;
![]() 鉴别晶体堆积方式的方法是X—射线衍射法;六方最密堆积空间利用率比体心立方堆积空间利用率高,由
鉴别晶体堆积方式的方法是X—射线衍射法;六方最密堆积空间利用率比体心立方堆积空间利用率高,由![]() 转变为
转变为![]() 晶体体积膨胀;
晶体体积膨胀;
故答案为:X—射线衍射法;膨胀;
![]() 由结构可知
由结构可知![]() 位于晶胞的顶点,数目为
位于晶胞的顶点,数目为![]() 个,
个,![]() 位于体心,有1个,
位于体心,有1个,![]() 位于面心,数目为
位于面心,数目为![]() 个,故化学式为
个,故化学式为![]() ,由晶胞结构可知
,由晶胞结构可知![]() ,所以
,所以 ;
;
故答案为:![]() ;
;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)常用于微电子工业,可用以下反应制备:4NH3+3F2=NF3+3NH4F,下列说法中,正确的是( )
A.NF3的电子式为![]()
B.NH4F分子中仅含离子键
C.在制备NF3的反应中,NH3表现出还原性
D.在制备NF3的反应方程式中,各物质均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收b kJ热量
B.该反应的反应热ΔH= +(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A键和1mol B-B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
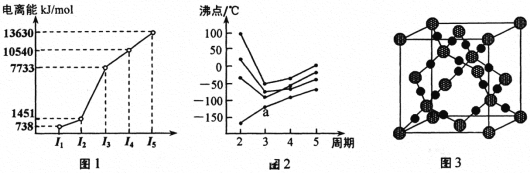
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
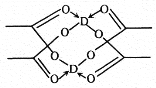
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

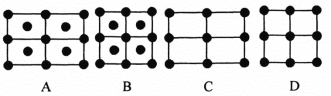
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
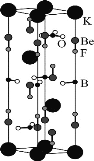
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
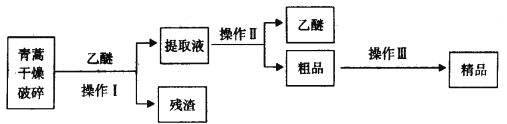
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
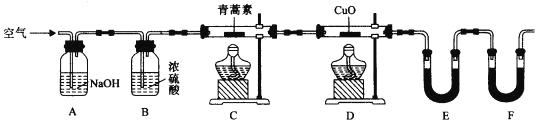
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
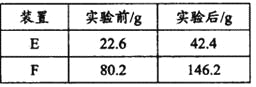
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
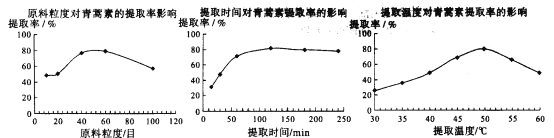
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com