
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
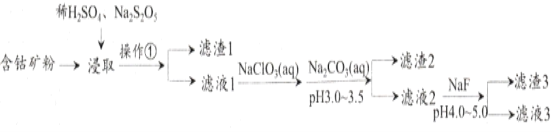
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
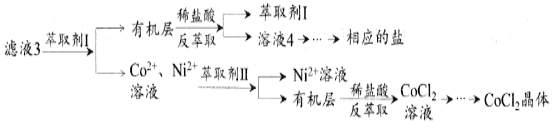
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。
【答案】过滤 氯酸钠 将正三价钴还原成正二价钴 将Fe2+氧化成Fe3+,便于分离 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ CaF2和MgF2 分离出溶液中的Mn2+、Cu2+、Zn2+,回收利用 降低烘干温度,防止产品分解,产生有毒的无水氯化钴
【解析】
流程题先找出原料和杂质,以及制备的物质,注意题中所给信息的运用,带着问题看流程,流程题一般是杂质的处理和物质的提纯;
(1)根据流程,操作①得到滤渣和滤液,即操作①为过滤;NaClO3具有氧化性,其名称为氯酸钠;
(2)根据信息①,Na2S2O5常作食品抗氧化剂,即Na2S2O5为还原剂,根据含钴矿中Co存在的化合价,以及该流程制备氯化钴,因此Na2S2O5将正三价钴还原成正二价钴;
(3)根据加入NaClO3后的操作,“加入Na2CO3,调节pH3.0~3.5”,其目的是让Fe3+以Fe(OH)3形式沉淀出来,除去铁元素,即加入NaClO3的目的是将Fe2+氧化成Fe3+,便于分离;反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)Na2CO3与Fe3+发生双水解反应,其离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(5)根据题中信息①,CaF2和MgF2难溶于水,因此滤渣3的成分是CaF2和MgF2;
(6)根据流程,把Fe、Si、Ca、Mg等杂质元素除去,而Cu、Zn、Mn、Ni等杂质还没除去,滤液3加入萃取剂I,得到有机层和Co2+、Ni2+,溶液,即有机层中含有Cu、Zn、Mn元素,因此加入稀盐酸反萃取的目的是分离出溶液中的Mn2+、Cu2+、Zn2+,回收利用;
(7)CoCl2·6H2O熔点86℃,易溶于水、乙醚等,常温下稳定无毒,加热至110-120℃时,失去结晶水变成有毒的无水氯化钴,因此减压环境下烘干的原因是降低烘干温度,防止产品分解,产生有毒的无水氯化钴。


科目:高中化学 来源: 题型:
【题目】碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22与O22+互为等电子体,O22+的电子式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cu和浓硫酸反应(装置中的夹持、加热仪器省略),反应后,圆底烧瓶内的混合液倒入水中,得到蓝色溶液与少量黑色不溶物。
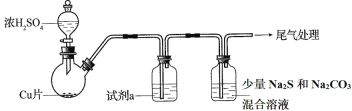
(1)反应后蓝色溶液呈酸性的原因有①______________,②______________。
(2)为检验反应产生气体的还原性,试剂 a 是______________。
(3)已知酸性:H2SO3>H2CO3>H2S。反应后测得 Na2S 和 Na2CO3 混合溶液中有新气体生成。该气体中 ______________ (填“含或不含”) H2S,理由是______________;
(4)少量黑色不溶物不可能是 CuO 的理由是______________。
查阅资料后发现该黑色固体可能是 CuS 或 Cu2S 中的一种或两种,且 CuS 和 Cu2S 在空气中煅烧易转 化成 Cu2O 和 SO2。称取 2.000g 黑色固体,灼烧、冷却、……最后称得固体 1.680g。
(5) 灼烧该固体除用到酒精灯、坩埚、坩埚钳、三脚架等仪器,还需要______________。 确定黑色固体灼烧充分的依据是______________,黑色不溶物其成分化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些常见有机物的转化如图下列说法正确的是( )
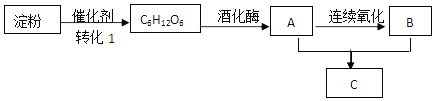
A.上述有机物中只有C6H12O6属于糖类物质
B.转化1可在人体内完成,该催化剂属于蛋白质
C.物质C和油脂类物质互为同系物
D.物质A和B都属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如下图所示:
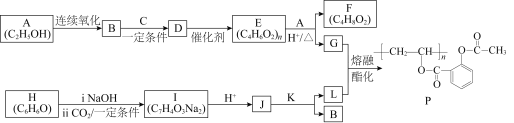
已知:①HC≡CH+RCOOH![]()
![]()
②RCOOR’+R”OH![]() RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
请回答:
(1)A中的官能团是____________________。
(2)C的结构简式是____________________。
(3)D→E的反应类型是____________________。
(4)E→G的化学方程式是______________________________________。
(5)已知:H是芳香族化合物。在一定条件下2B → K + H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是____________________。
(6)L在体内可较快转化为具有药效的J,而化合物P与L相比,在体内能缓慢持续释放J。
① 血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:______________________________________________________________。
② 下列说法正确的是______(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )
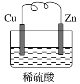
实验记录:
①导线中电流方向:Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见![]() 、
、![]() 和
和![]() 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠![]() 已知
已知 ![]() 是一种强氧化剂
是一种强氧化剂![]() ,其主要工艺流程如下:
,其主要工艺流程如下:
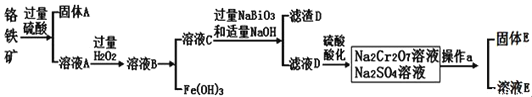
查阅资料得知:常温下,![]() 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将![]() 转化为
转化为![]()
回答下列问题:
![]() 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以![]() 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
![]() 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
![]() 固体E的主要成分是
固体E的主要成分是![]() ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
![]() 已知含
已知含![]() 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() 。
。
![]()
![]() 的化学性质与
的化学性质与 ![]() 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________![]() 用离子方程式表示
用离子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填选项序号
填选项序号![]() ;
;
A ![]() 溶液
溶液 ![]() 浓
浓![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 转移
转移![]() ,则加入
,则加入![]() 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
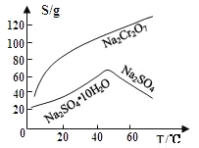
![]() 某厂废水中含
某厂废水中含![]() 的
的![]() ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 ![]() 的化合价为
的化合价为![]() ,Fe的化合价依次为
,Fe的化合价依次为![]() 、
、![]() 。欲使1L该废水中的
。欲使1L该废水中的 ![]() 完全转化为
完全转化为![]() 。理论上需要加入________
。理论上需要加入________![]() 。
。
![]() 已知
已知![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
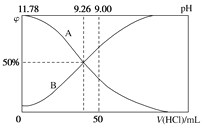
根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com