
【题目】下列关于有机物的说法正确的是( )
A. 油脂在人体内水解为氨基酸和甘油等小分子后被人体吸收
B. 甲酸甲酯(HCOOCH3)和乙酸是同分异构体
C. 石油催化裂化的主要目的是提高芳香烃的产量
D. 聚丙烯的结构简式为![]()
科目:高中化学 来源: 题型:
【题目】一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g ZnD. 反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA和2molB在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g)2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为30%④2s时物质B的浓度为0.7mol·L-1其中正确的是( )
A. ①③B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
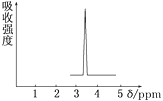
【题目】(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为______,请预测B的核磁共振氢谱上有________个峰(信号)。
(2)用系统命名法命名下列物质
①![]() ________________;②CH3CH2CH=CHCH3________________。
________________;②CH3CH2CH=CHCH3________________。
(3)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃结构简式____________________。
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,能与酸反应,也能与碱反应,还能发生水解反应的是( )
①![]() ;②氨基酸;③
;②氨基酸;③![]() ④淀粉⑤蛋白质⑥纤维素⑦
④淀粉⑤蛋白质⑥纤维素⑦
A.①②⑤B.③⑤⑦C.④⑤⑥D.①③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大 报告提出要“打赢蓝天保卫战”,意味着对大气污染防治比以前更高。二氧化硫-空气质子交换膜燃料电池将化学能转变成电能的同时, 实现了制硫酸、发电、环保三位一体的结合,降低了成本提高了效益, 其理原如图所示。下列说法错误的是
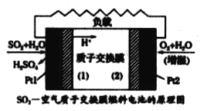
A.Ptl 电极附近发生的反应为:SO2+ 2H2O-2e- =SO42-+4H+
B.该电池放电时电子从Pt l电极经过外电路流到Pt2电极
C.Pt2电极附近发生的反应为O2+4e- =2O2-
D.相同条件下,放电过程中消耗的 SO2和O2的体积比为 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬的工艺流程如图:
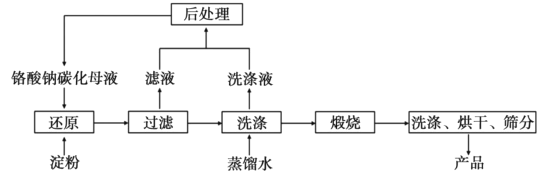
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液。
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式__。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是__(填标号)。
A.该反应一定无需加热即可进行
B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应
D.应建造废水回收池,回收含铬废水
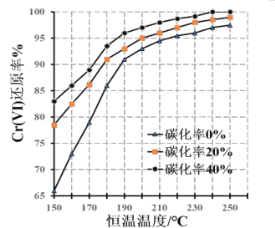
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_、__。
(4)滤液中所含溶质为__。该水热法制备氧化铬工艺的优点有__、__(写出两条即可)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为_。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com