
【题目】室温下,![]() ,
,![]() 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液混合
溶液混合![]() :
:![]()
C.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)],已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是( )
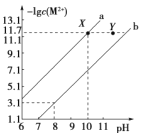
A.a线表示Fe(OH)2饱和溶液中的变化关系
B.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中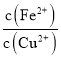 =104.6
=104.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组从乙烯出发按下列路线合成两种香料X和Y。具体合成路线如图所示(部分反应条件略去):
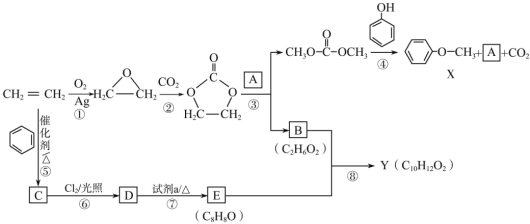
已知以下信息:
①![]()
![]() 2ROH+
2ROH+![]() ;
;
②![]()
![]()
![]() +H2O;
+H2O;
③E能发生银镜反应,1H-NMR谱图共有5个峰。
请回答:
(1)下列说法不正确的是______。
A.化合物C既能发生氧化反应,又能发生还原反应
B.1molE最多可以与3molH2发生加成反应
C.B可以和乙二酸发生缩聚反应
D.反应②为取代反应
(2)D![]() E的化学方程式是_____。
E的化学方程式是_____。
(3)化合物A的结构简式是______。
(4)写出同时符合下列条件的Y的所有同分异构体的结构简式:_____。
①能发生银镜反应,且与FeCl3溶液不会发生显色反应
②分子含苯环,1H-NMR谱图显示分子中有四种不同化学环境的氢原子
(5)参照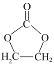 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备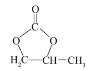 的合成路线______(用流程图表示,无机试剂任选)。
的合成路线______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L的烧瓶中充入一定量N2O4气体。
(1)体系中气体颜色由浅变深,写出对应的化学方程式____________________。
(2)保持温度和容积不变,向达到平衡的容器中再充入一定量N2O4气体,平衡________移动(填“正向”、“逆向”或“不”),N2O4的转化率___________(填“增大”、“减小”或“不变”,下同),反应的平衡常数___________。
(3)某小组为研究温度对化学平衡移动的影响,设计如图实验。图方案还需补充的是_____________(用文字表达);实验现象为______________________。

(4)在一定条件下,N2O4和NO2的消耗速率与压强关系为:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c(NO2),设达到平衡时c(N2O4)=1 mol/L,则(1)中反应的平衡常数为_________(用k1、k2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向![]() 、
、![]() 的饱和溶液中滴加少量
的饱和溶液中滴加少量![]() 溶液,溶液中
溶液,溶液中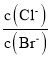 不变
不变
B.向![]() 的
的![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中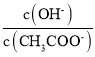 增大
增大
C.![]() 被完全还原为
被完全还原为![]() 时,转移的电子数约为
时,转移的电子数约为![]()
D.一定条件下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。


请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是__________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银精矿(其化学成分有:Ag、Zn、Cu、Pb、S 及 SiO2 等)从其中提取银及铜和铅的工艺流程如图:

回答下列问题:
(1)“浸取”时,当盐酸的浓度和 KClO3 的量一定时,为提高浸取率可采取的措施是______(请用简练语言列举一项)。
(2)“分离Ⅰ”所加试剂 X 为______,“分离Ⅱ”所得滤渣中除含单质硫外,还含有的成分有______。
(3)“浸银”反应的化学方程式为______
(4)N2H4 的电子式为______,“还原”反应的离子方程式为______。
(5)“粗银”(含 Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是______(写出一条即可)。
(6)此类工厂排出的废水中含有 NO3-,对人体有害。科技人员在碱性条件下用 Al 粉将 NO3-还原为 N2。缺点是处理后的水中引入了 AlO2-,仍然对人体健康有害。
已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 Al(OH)3H+ + AlO2- + H2O K=1.0×10-13
①25℃时,欲将上述处理过水中的 AlO2- 浓度降到 1.0×10-6 mol/L,此时水中 c(Al3+)=______mol/L。
②25℃时,Al(OH)3 溶于 NaOH 溶液反应的平衡常数 K=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是

A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/ mol。
2NO2(g) ΔH=+24.4 kJ/ mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是____
a v正(N2O4)=2v逆(NO2) b 体系颜色不变
c 气体平均相对分子质量不变 d 气体密度不变
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式_________(用p总、各气体物质的量分数用x表示);
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×104s-1,当N2O4分解10%时,v正=_______kPa·s-1。(结果保留两位有效数字)
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com