
【题目】下列说法正确的是( )
A.向![]() 、
、![]() 的饱和溶液中滴加少量
的饱和溶液中滴加少量![]() 溶液,溶液中
溶液,溶液中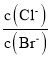 不变
不变
B.向![]() 的
的![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中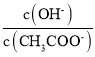 增大
增大
C.![]() 被完全还原为
被完全还原为![]() 时,转移的电子数约为
时,转移的电子数约为![]()
D.一定条件下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程。
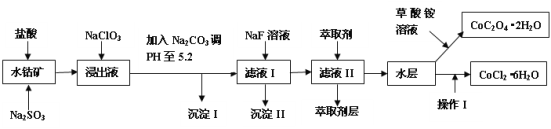
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的离子方程式为___。
(2)在浸出液中加入NaClO3的作用是___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀II的主要成分___。
(4)操作I中包括蒸发浓缩的过程,在蒸发浓缩之前应先向溶液中加入_______(填试剂名称)。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥、称重。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49 g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则在150℃~210℃温度范围放出的气体物质是_______,290℃~320℃温度范围,剩余的固体物质化学式为________。
[已知:CoC2O4·2H2O的摩尔质量为183 g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照①⑥在表中的位置,用化学用语回答下列问题。
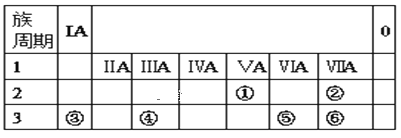
(1)元素①的原子结构示意图为__。
(2)元素②、③、⑥原子的半径大小(从大到小排列)___。
(3)元素⑤、⑥形成的气态氢化物稳定性___。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g)![]() Hb(O2)。下列说法正确的是
Hb(O2)。下列说法正确的是
A.体温升高,O2与Hb结合更快,反应的平衡常数不变
B.吸入新鲜空气,平衡逆向移动
C.CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大
D.高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g)![]() Hb(O2)+CO(g)右移
Hb(O2)+CO(g)右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是重要的药物中间体,合成路线如下:

回答下列问题:
(1)A的分子式为_________。
(2)B中含氧官能团的名称为_________。
(3)D→E的反应类型为_________。
(4)已知B与(CH3CO)2O的反应比例为1:2,B→C的反应方程式为_________。
(5)路线中②④的目的是_________。
(6)满足下列条件的B的同分异构体有_________种(不考虑立体异构)。
①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应且能发生银镜反应
写出其中核磁共振氢谱为五组峰的物质的结构简式为_________。
(7)参考上述合成线路,写出以1-溴丁烷、丙二酸二乙酯、尿素[CO(NH2)2]为起始原料制备 的合成线路(其它试剂任选)_________。
的合成线路(其它试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() ,
,![]() 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液混合
溶液混合![]() :
:![]()
C.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用![]() 溶液吸收烟气中的
溶液吸收烟气中的![]() 并回收硫,其实验流程如图:
并回收硫,其实验流程如图:
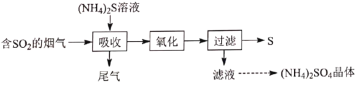
已知吸收时发生下列反应:
Ⅰ.![]() ;
;![]()
Ⅱ.![]() ;
;![]() 。
。
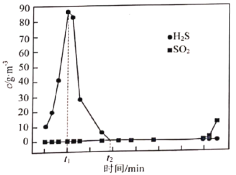
(1)其他条件一定,检测出尾气中![]() 、
、![]() 浓度随通入烟气时间变化见图,则
浓度随通入烟气时间变化见图,则![]() 段
段![]() 浓度变化的主要原因是_________。
浓度变化的主要原因是_________。
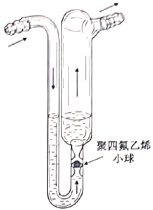
(2)为提高烟气中![]() 的吸收率,可探究气体流速、温度等实验条件的影响。
的吸收率,可探究气体流速、温度等实验条件的影响。
①烟气进入吸收装置前通过的鼓泡器如图所示,鼓泡器中充入甲基硅油等性质稳定的液体。该装置的作用为________。
②反应温度过高,吸收率会下降,其原因是_______。
③还可探究的影响吸收率的实验条件有__________。
(3)氧化阶段,在高压加热条件下,![]() 与
与![]() 反应生成S和
反应生成S和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(4)滤液中还有少量![]() 。设计以滤液为原料,制取
。设计以滤液为原料,制取![]() 晶体的实验方案:________[已知
晶体的实验方案:________[已知![]() 在280℃以上分解;其在水中溶解度0℃时为
在280℃以上分解;其在水中溶解度0℃时为![]() ,100℃时为
,100℃时为![]() ;不溶于乙醇]。
;不溶于乙醇]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
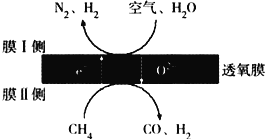
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
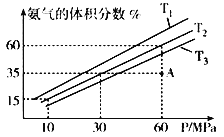
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com