
【题目】下表为元素周期表的一部分,请参照①⑥在表中的位置,用化学用语回答下列问题。
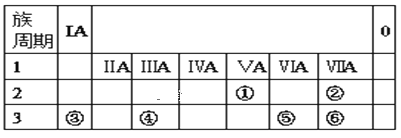
(1)元素①的原子结构示意图为__。
(2)元素②、③、⑥原子的半径大小(从大到小排列)___。
(3)元素⑤、⑥形成的气态氢化物稳定性___。
(4)元素④的最高价氧化物的水化物与元素③的最高价氧化物的水化物稀溶液反应的离子方程式为___。
【答案】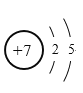 Na>Cl>F HCl>H2S Al(OH)3+OH-=AlO2-+2H2O
Na>Cl>F HCl>H2S Al(OH)3+OH-=AlO2-+2H2O
【解析】
根据周期表中的位置各元素分别为:①N②F③Na④Al⑤S⑥Cl
(1)元素①为N,N的原子结构示意图为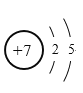 。故答案为:
。故答案为: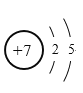 ;
;
(2)同一周期从左到右,原子半径由大变小,Na>Cl,同一主族,从上到下半径变大,Cl>F,元素②、③、⑥原子的半径大小(从大到小排列)Na>Cl>F。故答案为:Na>Cl>F;
(3)S、Cl在同一周期,从左到右元素的非金属性变大,氢化物的稳定性增强,元素⑤、⑥形成的气态氢化物稳定性HCl>H2S。故答案为:HCl>H2S;
(4)元素④的最高价氧化物的水化物Al(OH)3与元素③的最高价氧化物的水化物NaOH稀溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。故答案为:Al(OH)3+OH-=AlO2-+2H2O。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料发生如图所示的变化,可以合成高聚物G。
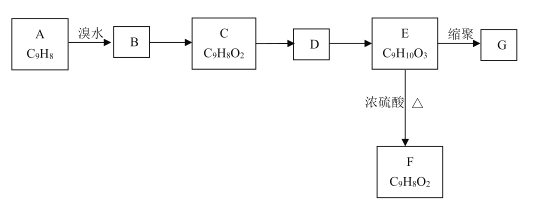
已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是________;C的结构简式为_________。
(2)B→C的反应条件是________,E→F的反应类型是_________。
(3)写出E→G的化学方程式________。
(4)E的同分异构体中,苯环上有4个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。其中核磁共振氢谱显示有4组峰的结构简式为________(写出一种即可)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(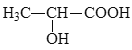 )的合成路线________(无机试剂任选)。
)的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
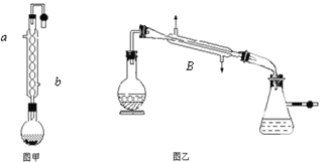
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
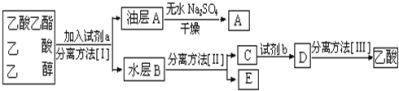
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
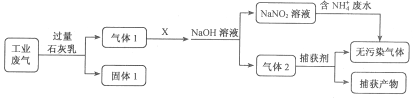
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组从乙烯出发按下列路线合成两种香料X和Y。具体合成路线如图所示(部分反应条件略去):
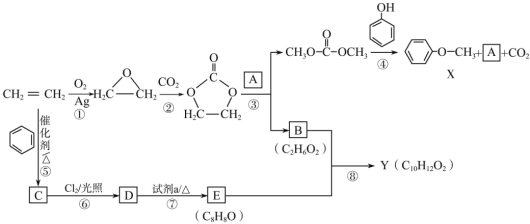
已知以下信息:
①![]()
![]() 2ROH+
2ROH+![]() ;
;
②![]()
![]()
![]() +H2O;
+H2O;
③E能发生银镜反应,1H-NMR谱图共有5个峰。
请回答:
(1)下列说法不正确的是______。
A.化合物C既能发生氧化反应,又能发生还原反应
B.1molE最多可以与3molH2发生加成反应
C.B可以和乙二酸发生缩聚反应
D.反应②为取代反应
(2)D![]() E的化学方程式是_____。
E的化学方程式是_____。
(3)化合物A的结构简式是______。
(4)写出同时符合下列条件的Y的所有同分异构体的结构简式:_____。
①能发生银镜反应,且与FeCl3溶液不会发生显色反应
②分子含苯环,1H-NMR谱图显示分子中有四种不同化学环境的氢原子
(5)参照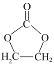 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备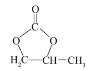 的合成路线______(用流程图表示,无机试剂任选)。
的合成路线______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是
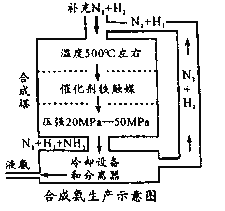
A.增大压强既可以加快反应速率,又可以提高原料转化率
B.升高温度可提高平衡转化率
C.冷却过程中采用热交换有助于节约能源
D.原料循环可提高其利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向![]() 、
、![]() 的饱和溶液中滴加少量
的饱和溶液中滴加少量![]() 溶液,溶液中
溶液,溶液中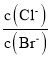 不变
不变
B.向![]() 的
的![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中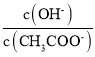 增大
增大
C.![]() 被完全还原为
被完全还原为![]() 时,转移的电子数约为
时,转移的电子数约为![]()
D.一定条件下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________(填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________(混合过程中溶液的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com