
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
【答案】D
【解析】
对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题。
A.对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,故A错误;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.Ⅱ浓度较大,Ⅲ温度较高,增大浓度平衡正向移动,升高温度平衡逆向移动,Ⅲ的转化率降低,Ⅲ中相当于起始C(H2)为Ⅱ的一半,平衡时Ⅱ中C(H2)小于Ⅲ中的两倍,故C错误;
D.对比Ⅰ、Ⅲ,Ⅲ温度较高,浓度相当,升高温度,正逆反应速率增大,则容器Ⅲ中的反应速率比容器Ⅰ中的大,故D正确。
故选: D。


科目:高中化学 来源: 题型:
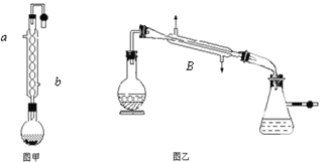
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
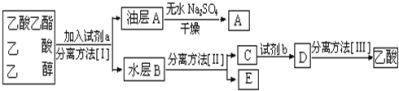
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向![]() 、
、![]() 的饱和溶液中滴加少量
的饱和溶液中滴加少量![]() 溶液,溶液中
溶液,溶液中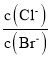 不变
不变
B.向![]() 的
的![]() 溶液中加入少量水,溶液中
溶液中加入少量水,溶液中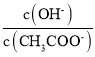 增大
增大
C.![]() 被完全还原为
被完全还原为![]() 时,转移的电子数约为
时,转移的电子数约为![]()
D.一定条件下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银精矿(其化学成分有:Ag、Zn、Cu、Pb、S 及 SiO2 等)从其中提取银及铜和铅的工艺流程如图:

回答下列问题:
(1)“浸取”时,当盐酸的浓度和 KClO3 的量一定时,为提高浸取率可采取的措施是______(请用简练语言列举一项)。
(2)“分离Ⅰ”所加试剂 X 为______,“分离Ⅱ”所得滤渣中除含单质硫外,还含有的成分有______。
(3)“浸银”反应的化学方程式为______
(4)N2H4 的电子式为______,“还原”反应的离子方程式为______。
(5)“粗银”(含 Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是______(写出一条即可)。
(6)此类工厂排出的废水中含有 NO3-,对人体有害。科技人员在碱性条件下用 Al 粉将 NO3-还原为 N2。缺点是处理后的水中引入了 AlO2-,仍然对人体健康有害。
已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 Al(OH)3H+ + AlO2- + H2O K=1.0×10-13
①25℃时,欲将上述处理过水中的 AlO2- 浓度降到 1.0×10-6 mol/L,此时水中 c(Al3+)=______mol/L。
②25℃时,Al(OH)3 溶于 NaOH 溶液反应的平衡常数 K=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
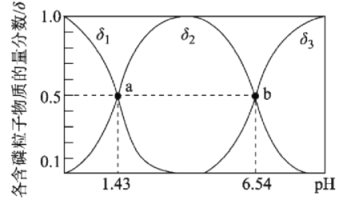
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是

A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃,H2C2O4的K1=5.0×10-2,K2=5.0×10-5。则NaHC2O4溶液显__________(填“酸性”或“碱性”)。
(2)已知25℃,H2CO3的K1=4×10-7,K2=5×10-11。CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为__________(写离子符号);若所得溶液中c(HCO3-):c(CO32-)=2:1,则溶液pH=__________。
(3)25℃时,V1L pH=11的NaOH溶液与V2L pH=3的H2SO4溶液混合,所得溶液的pH=10,则V1:V2=__________(混合过程中溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是
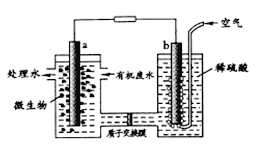
A. a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
B. 质子交换膜处H+由右向左移动
C. 该电池在微生物作用下将化学能转化为电能
D. 开始放电时b极附近pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种![]() 的系统,借助锂循环可持续合成氨,其原理如图所示:
的系统,借助锂循环可持续合成氨,其原理如图所示:
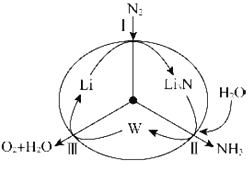
(1)过程Ⅰ得到Li3N的电子式为___________。
(2)过程Ⅱ生成W的化学反应方程式为____________。
(3)实验室制取氨气的化学反应方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com