
【题目】银精矿(其化学成分有:Ag、Zn、Cu、Pb、S 及 SiO2 等)从其中提取银及铜和铅的工艺流程如图:

回答下列问题:
(1)“浸取”时,当盐酸的浓度和 KClO3 的量一定时,为提高浸取率可采取的措施是______(请用简练语言列举一项)。
(2)“分离Ⅰ”所加试剂 X 为______,“分离Ⅱ”所得滤渣中除含单质硫外,还含有的成分有______。
(3)“浸银”反应的化学方程式为______
(4)N2H4 的电子式为______,“还原”反应的离子方程式为______。
(5)“粗银”(含 Ag、Cu、Zn、Au)可用立式电解槽电解精炼,纯银作阴极,电解液采用硝酸和硝酸银的混合溶液。硝酸浓度不能过大,其原因是______(写出一条即可)。
(6)此类工厂排出的废水中含有 NO3-,对人体有害。科技人员在碱性条件下用 Al 粉将 NO3-还原为 N2。缺点是处理后的水中引入了 AlO2-,仍然对人体健康有害。
已知:25℃时,Ksp[Al(OH)3]=1.3×10-33 Al(OH)3H+ + AlO2- + H2O K=1.0×10-13
①25℃时,欲将上述处理过水中的 AlO2- 浓度降到 1.0×10-6 mol/L,此时水中 c(Al3+)=______mol/L。
②25℃时,Al(OH)3 溶于 NaOH 溶液反应的平衡常数 K=______。
【答案】充分搅拌、粉碎银精矿、适当增大液固比、适当提高浸取温度、适当延长浸取时间 Zn SiO2 AgCl + 2Na2SO3 = Na3[Ag(SO3)2] + NaCl ![]() 4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O 防止生成的银被硝酸溶解;防止 NO3-优先于 Ag+在阴极放电 1.3×10-12 10
4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O 防止生成的银被硝酸溶解;防止 NO3-优先于 Ag+在阴极放电 1.3×10-12 10
【解析】
银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)加盐酸和氯酸钾浸取,过滤,溶液中含有Zn2+、Cu2+、Pb2+,滤渣中含有S、SiO2、AgCl等;浸出液中加金属还原剂Zn,把Cu2+、Pb2+还原为单质,则试剂X为Zn,分离得到Cu和Pb、ZnCl2溶液;浸出渣含有S、SiO2、AgCl,加Na2SO3溶液,AgCl与Na2SO3反应生成Na3[Ag(SO3)2]和NaCl,过滤,滤渣为S和SiO2,滤液为Na3[Ag(SO3)2]和NaCl,在滤液中加N2H4,生成Ag和氮气;滤液中含有亚硫酸钠,氧化生成硫酸钠,以此解答该题。
(1)浸取时当盐酸的浓度和KClO3的量一定时,要加快化学反应速率的方法有:充分搅拌、粉碎银精矿、适当增大液固比、适当提高浸取温度、适当延长浸取时间,选择其中任意两种方法即可;
(2)分离得到氯化锌溶液可知加入的试剂X为Zn;根据分析可知“分离Ⅱ”所得滤渣中除含单质硫外,还含有SiO2;
(3)根据流程可知,浸银的反应物为AgCl和Na2SO3溶液,产物有Na3[Ag(SO3)2],根据元素守恒可知反应方程式为:AgCl+2Na2SO3=Na3[Ag(SO3)2]+NaCl;
(4)N2H4 的电子式为![]() ;根据流程可知还原时主要反应物有Na3[Ag(SO3)2] 和N2H4,主要产物为氮气和Ag,可知反应过程银离子被还原,N2H4中氮元素被氧化,生成氮气,根据电子守恒和元素守恒可知离子方程式为:4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O;
;根据流程可知还原时主要反应物有Na3[Ag(SO3)2] 和N2H4,主要产物为氮气和Ag,可知反应过程银离子被还原,N2H4中氮元素被氧化,生成氮气,根据电子守恒和元素守恒可知离子方程式为:4[Ag(SO3)2]3- + N2H4 + 4OH- = 4Ag↓ + 8SO32- + N2↑ + 4H2O;
(5)浓硝酸具有强氧化性能氧化Ag,生成硝酸银溶液,所以硝酸浓度不能过大,防止生成的银被硝酸溶解;同时溶液中有大量硝酸根离子,还要防止 NO3-优先于 Ag+在阴极放电;
(6))①水中AlO2-浓度降到1.0×10-6molL-1,依据Al(OH)3AlO2-+H++H2O,K=1.0×10-13,则c(H+)=![]() =10-7(mol/L),则c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]= c3(OH-)·c(Al3+)=1.3×10-33,则c(Al3+)=
=10-7(mol/L),则c(OH-)=10-7mol/L,25℃时,Ksp[Al(OH)3]= c3(OH-)·c(Al3+)=1.3×10-33,则c(Al3+)= =1.3×10-12molL-1;
=1.3×10-12molL-1;
②由①H2OOH-+H+、②Al(OH)3AlO2-+H++H2O 可知,②-①得到OH-+Al(OH)3AlO2-+H+,则Al(OH)3溶于NaOH溶液反应的平衡常数数值为K=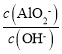 =
=![]() =10。
=10。


科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
A.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
B.分子中含有4种官能团,3个手性碳原子
C.可发生消去反应,形成芳香族化合物
D.1mol分枝酸最多可与3mol NaOH发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g)![]() Hb(O2)。下列说法正确的是
Hb(O2)。下列说法正确的是
A.体温升高,O2与Hb结合更快,反应的平衡常数不变
B.吸入新鲜空气,平衡逆向移动
C.CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大
D.高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g)![]() Hb(O2)+CO(g)右移
Hb(O2)+CO(g)右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() ,
,![]() 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液混合
溶液混合![]() :
:![]()
C.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用![]() 溶液吸收烟气中的
溶液吸收烟气中的![]() 并回收硫,其实验流程如图:
并回收硫,其实验流程如图:
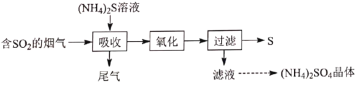
已知吸收时发生下列反应:
Ⅰ.![]() ;
;![]()
Ⅱ.![]() ;
;![]() 。
。
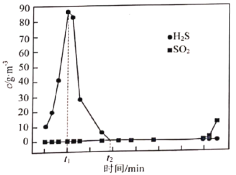
(1)其他条件一定,检测出尾气中![]() 、
、![]() 浓度随通入烟气时间变化见图,则
浓度随通入烟气时间变化见图,则![]() 段
段![]() 浓度变化的主要原因是_________。
浓度变化的主要原因是_________。
(2)为提高烟气中![]() 的吸收率,可探究气体流速、温度等实验条件的影响。
的吸收率,可探究气体流速、温度等实验条件的影响。
①烟气进入吸收装置前通过的鼓泡器如图所示,鼓泡器中充入甲基硅油等性质稳定的液体。该装置的作用为________。
②反应温度过高,吸收率会下降,其原因是_______。
③还可探究的影响吸收率的实验条件有__________。
(3)氧化阶段,在高压加热条件下,![]() 与
与![]() 反应生成S和
反应生成S和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(4)滤液中还有少量![]() 。设计以滤液为原料,制取
。设计以滤液为原料,制取![]() 晶体的实验方案:________[已知
晶体的实验方案:________[已知![]() 在280℃以上分解;其在水中溶解度0℃时为
在280℃以上分解;其在水中溶解度0℃时为![]() ,100℃时为
,100℃时为![]() ;不溶于乙醇]。
;不溶于乙醇]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标明下列反应电子转移情况,并根据要求回答问题。
(1)3NO2+H2O=2HNO3+NO_______
(2)氧化剂____________还原剂____________氧化产物____________还原产物__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
(1)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应。
)的铜配合物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性由小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NH2中N原子的杂化方式为__杂化。
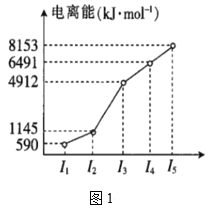
(2)第四周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素的基态原子电子排布式为___。
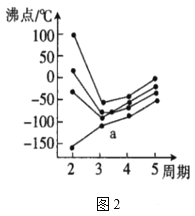
①嘌呤中轨道之间的夹角∠1比∠2大,原因是___。
②![]() 分子中的大π键可以用符号
分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
(3)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图3所示。
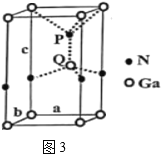
若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120o,阿伏加德罗常数的值为NA,则晶胞参数c=__(写出代数式)nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将铁粉加入![]() 、
、![]() 混合溶液中,充分反应后剩余的固体中必有铁
混合溶液中,充分反应后剩余的固体中必有铁
B.将![]() 和
和![]() 混合气体分别通入
混合气体分别通入![]() 溶液、
溶液、![]() 溶液中,最终都有沉淀生成
溶液中,最终都有沉淀生成
C.检验某酸性溶液中![]() 和
和![]() ,选用试剂及顺序是过量
,选用试剂及顺序是过量![]() 溶液、
溶液、![]() 溶液
溶液
D.用加热分解的方法可将![]() 固体和Ca(OH)2固体的混合物分离
固体和Ca(OH)2固体的混合物分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com