
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |
科目:高中化学 来源: 题型:
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀硫酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
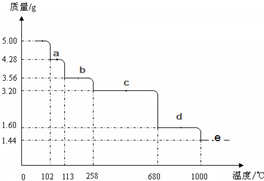
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
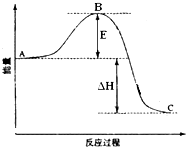 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ | ||
| B、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度顺序:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
| C、根据滴定曲线,可得Ka(HY)≈10-5 | ||
D、HY与HZ混合,达到平衡时:c(H+)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
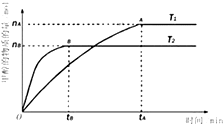 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.| nA |
| tA |
| n(H2) |
| n(CH3OH ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com