
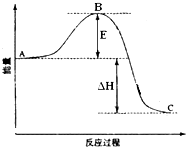
 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| J | ||||
| R |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
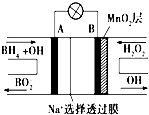 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
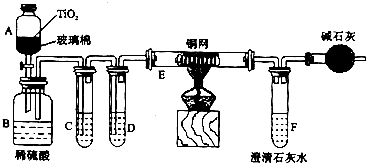
查看答案和解析>>
科目:高中化学 来源: 题型:
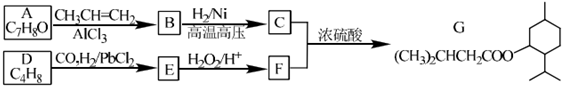
| PbCl2 |
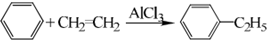
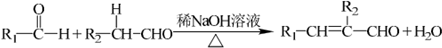
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com