
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
科目:高中化学 来源: 题型:
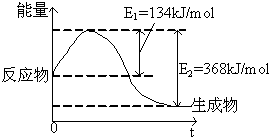 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀硫酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
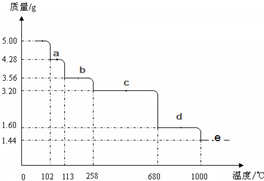
查看答案和解析>>
科目:高中化学 来源: 题型:
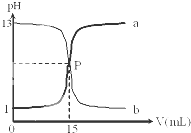 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:查看答案和解析>>
科目:高中化学 来源: 题型:
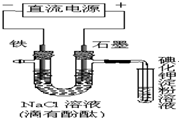
| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
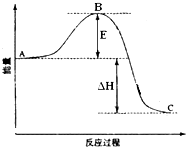 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
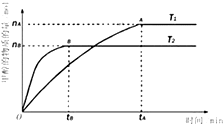 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.| nA |
| tA |
| n(H2) |
| n(CH3OH ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com