
| J | ||||
| R |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(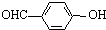 )和邻羟基苯甲醛( )和邻羟基苯甲醛(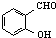 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
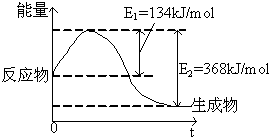 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,不必限量使用 |
| B、“面粉增白剂”中的CaO2具有强氧化性 |
| C、制作“毒豆芽”所用的亚硝酸钠(NaNO2)和使猪肉变“牛肉”时掺入的硼砂(Na2B4O7?10H2O)都属于钠盐 |
| D、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:
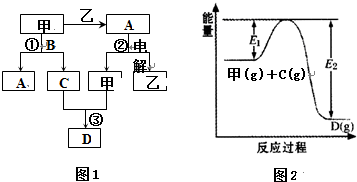
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| O2 |
| △ |
| 焙烧 |
| 足量稀硫酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
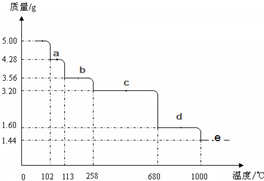
查看答案和解析>>
科目:高中化学 来源: 题型:
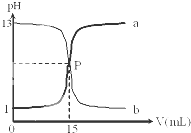 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:查看答案和解析>>
科目:高中化学 来源: 题型:
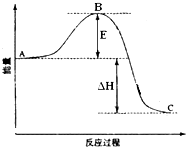 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com