
【题目】下列叙述正确的是( )
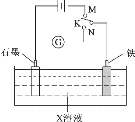
A.K与N连接时,X为硫酸,一段时间后溶液的pH减小
B.K与N连接时,X为氯化钠,石墨电极的电势更高
C.K与M连接时,X为硫酸,一段时间后溶液的pH增大
D.K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑
【答案】B
【解析】
A.K与N连接时,该装置为原电池,X为硫酸溶液时,铁失电子生成亚铁离子,正极上氢离子得电子生成氢气,导致溶液中氢离子浓度减小,溶液的pH增大,故A错误;
B.K与N连接时,该装置是原电池,X为氯化钠,铁发生吸氧腐蚀,铁作负极,石墨电极为正极,即石墨电极的电势更高,故B正确;
C.K与M连接时,该装置为电解池,X为硫酸,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解水,硫酸的浓度逐渐增大,则溶液的pH减小,故C错误;
D.K与M连接时,该装置为电解池,X为氯化钠,石墨作阳极铁作阴极,石墨电极上氯离子失电子发生氧化反应,电极反应式为2Cl--2e-=Cl2↑,故D错误;
故答案为B。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO42-、SO32-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图。下列有关推断不正确的是( )
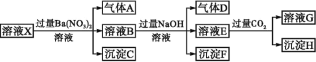
A.溶液X中一定含有NH4+、Al3+、H+、Fe2+、SO42-
B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C.沉淀H为Al(OH)3、BaCO3的混合物
D.若溶液X为100 mL,产生的气体A为44.8 mL(标准状况),则X中c(Fe2+)=0.06 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将CuSO4·5H2O(s)溶于水会使溶液温度降低,将 CuSO4(s)溶于水会使溶液温度升高。则下列能量转化关系不正确的是
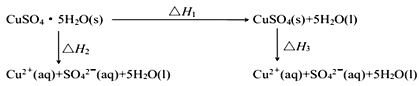
A.ΔH1>0B.ΔH2<ΔH3C.ΔH3<ΔH1D.ΔH2=ΔH1+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成氨是现代合成氨工业发展的方向与趋势
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:
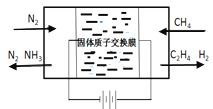
写出在阴极表面发生的电极反应式:_____________。
(二)天然气为原料合成氨技术简易流程如下:

一段转化主要发生的反应如下:
①CH4(g) +H2O(g) ![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g) ![]() 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) ![]() 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能_________。
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数_________。
(3)下列说法正确的是_________。
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:

①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是________。
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
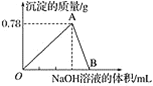
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:
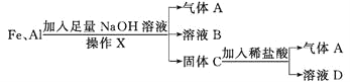
(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+ Zn + (1+x/6) H2O + ZnSO4![]() MnOOH + ZnSO4[Zn(OH)2]3·xH2O其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是( )
MnOOH + ZnSO4[Zn(OH)2]3·xH2O其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是( )

A.碳纳米管具有导电性,可用作电极材料
B.放电时,电池的正极反应为:MnO2 + e + H+ == MnOOH
C.充电时,Zn2+移向Zn膜
D.有机高聚物是一种混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题:
(1)A元素在周期表中的位置:____;B、D两元素形成化合物的化学式:_________。
(2)元素B、C、D的简单离子半径的大小顺序:____________(用离子符号回答)。
(3)C、D两元素最高价氧化物对应水化物的碱性强弱关系: > (用化学式表示)。________
(4)B、C形成的化合物在D元素最高价氧化物对应水化物的溶液中反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等.
⑴某同学在实验室中根据2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-196.6kJmol-1,设计如图所示实验装置来制备SO3固体,请完成下列问题:
2SO3(g) ΔH =-196.6kJmol-1,设计如图所示实验装置来制备SO3固体,请完成下列问题:
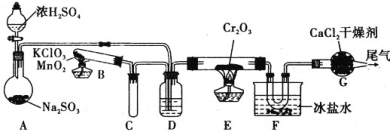
①在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸,加几滴水的作用是________。
②装置D的作用是________、________、________。
③实验开始时的操作顺序为(_______)
a.先加热E处的酒精灯后将混合气体通入E
b.先将混合气体通入E后加热E处的酒精灯
⑵浓硫酸具有强氧化性.某同学用下列装置来检验木炭能否被浓硫酸氧化成CO2
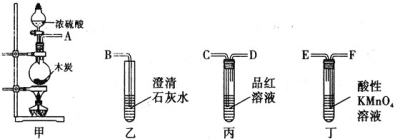
①按气流从左向右流动,连接装置的正确顺序是(用各接口字母表示) ________。
②若能被氧化成CO2,实验现象是________。
③写出装置丁中可能发生的离子反应方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com