
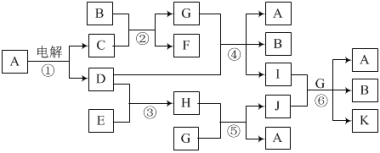
【题目】有关物质的转化关系如下图所示,A为常见调味品,B为常见液体,C、E是金属。D、F为气态单质,其中D为黄绿色。J为红褐色固体,A、C、G、I、K的焰色反应均为黄色。K是一种含+6价元素的含氧酸盐,其摩尔质量为166 g·mol-1。
(1)物质B的电子式为___。物质D所含元素在周期表中的位置是___。
(2)写出反应②的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(3)写出反应④的离子方程式:___。
(4)写出反应⑥的化学方程式:___。
【答案】![]() 第三周期,ⅦA族
第三周期,ⅦA族 ![]() Cl2+2OH-=Cl-+ClO-+H2O 3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O
Cl2+2OH-=Cl-+ClO-+H2O 3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O
【解析】
A、C、G、I、K的焰色反应均为黄色,说明均含有Na元素,其中A为常见调味品,反应①中电解A生成C与D,而C为金属、D为黄绿色气体单质,则A为NaCl、C为Na、D为Cl2;B为常见液体,由反应②B+Na→G+F、反应④G+氯气→NaCl+B+I,可知B为H2O、G为NaOH、I为NaClO;由反应③金属E+氯气→H、反应④H+NaOH→NaCl+J,且J为红褐色固体,可知E为Fe、H为FeCl3、J为Fe(OH)3;K是一种含+6价元素的含氧酸盐,由元素守恒可知K中还含有Fe元素、Na元素,可知K为Na2FeO4。
(1)物质B为H2O,其电子式为![]() 。物质D中所含元素为Cl,在周期表中的位置是:第三周期第VIIA族;
。物质D中所含元素为Cl,在周期表中的位置是:第三周期第VIIA族;
(2)反应②是钠与水的反应:2Na+2H2O=2NaOH+H2↑,Na失去电子,H2O中H得到电子,用单线桥表示电子转移的方向和数目:![]() ;
;
(3)反应④为Cl2与OH-反应生成NaCl、NaClO、H2O,其反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)反应⑥的化学方程式为NaClO在NaOH环境下与Fe(OH)3反应生成Na2FeO4、NaCl、H2O,NaClO中Cl元素化合价降低2价,Fe(OH)3中Fe元素化合价升高3价,根据氧化还原反应化合价升降守恒、原子守恒写出其化学反应方程式为:3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O。


科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )
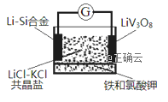
A. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 组装该电池应当在无水、无氧的条件下进行
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
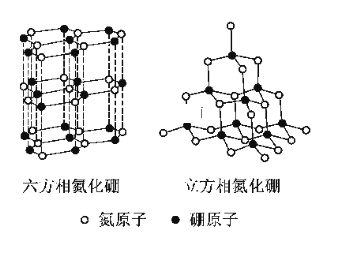
A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是_______,其价电子排布式为______。
(2)第四电离能大小:I4(Fe)> I4(Co),从原子结构的角度分析可能的原因是____。
(3)取1mol配合物CoCl3·6NH3(黄色)溶于水,加入足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为_______。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式_____;生成气体分子的中心原子杂化方式为____。
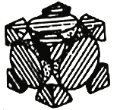
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下钴原子的半径为r,则该晶体的空间利用率为______(列出表达式并写出最终结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
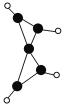
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和戊烷类似,容易发生取代反应
D. 充分燃烧等质量的X和甲烷,甲烷消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,可在铜的催化作用下由F2和过量NH3反应得到,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3,请根据要求回答下列问题:
(1)写出制备NF3的化学反应方程式:______________________________。反应过程中,氧化剂与还原剂的物质的量之比为________。
(2)写出三氟化氮与水蒸气反应的化学方程式:______________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_____________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种钠盐:_________________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
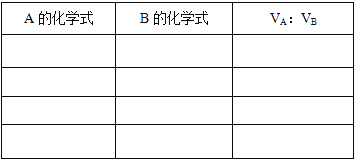
【题目】饱和烃A和不饱和烃B在常温下均为气体,其中A含的碳原子数多于B。将A、B按一定比例混合,1L混合气体完全燃烧后在同温同压下得到3.6LCO2。
(1)试推断该混合气体的可能组成及A、B混合时的体积比,将结果填入表中。_______________________
(2)1mol该混合气体恰好能使含0.2mol溴的四氯化碳溶液完全褪色,则A和B的化学式分别为________和_________。
(3)1mol该混合气体在氧气中完全燃烧,得到68.4g水,则A和B的化学式分别为_________和__________。
(4)120℃时,1LA和1LB与足量O2混合后点燃,在同温同压下体积增大2L,则A和B的化学式分别为_________和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应生成的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:(夹持装置未画出)
①按图组装好实验装置后,首先进行的操作是_____。
②称取样品,将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是____。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C和U形管D的质量。
关于以上实验方案,请回答下列问题。
(2)若反应后不鼓入空气,会导致测量的NaCl质量分数___。(填“偏大”、“偏小”或“无影响”)。
(3)E处干燥管中盛放的药品是____,其作用是____,如果没有该装置,会导致测量的NaHCO3的质量分数___(填“偏大”、“偏小”或“无影响”)。
(4)若样品质量为wg,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为____(用含w、m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com