
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;

(1)写出选用物质的名称:A_________,B________,C________;上述反应的离子方程式____________;___________。
乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(2)乙同学的实验原理是 _______________,写出B处的离子方程式: _______________。
【答案】稀硝酸 碳酸钙 硅酸钠溶液 CaCO3+2H+=Ca2++2CO2↑+H2O SiO32-+CO2+H2O═H2SiO3↓+CO32- 活泼的非金属单质置换较不活泼的非金属单质 2I-+Cl2=2Cl-+I2
【解析】
(1)根据信息知道:甲同学根据元素非金属性与对应最高价含氧酸之间的关系如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸分析解答;
(2)根据氧化性强的单质可以将氧化性弱的单质从其盐中置换出来结合反应产物来分析解答。
(1)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则元素的非金属性越强,依据强酸制弱酸来设计反应,所以A为稀硝酸,B为碳酸钙,C为硅酸钠溶液,硝酸与碳酸钙反应生成二氧化碳、硝酸钙和水,其反应的离子方程式为:CaCO3+2H+═Ca2++2CO2↑+H2O;二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-,故答案为:稀硝酸;碳酸钙;硅酸钠溶液;CaCO3+2H+=Ca2++2CO2↑+H2O;SiO32-+CO2+H2O═H2SiO3↓+CO32-
(2)根据题干信息:乙同学设计了如图2装置来验证卤族元素性质的递变规律,所以乙同学的实验原理是活泼的非金属单质置换较不活泼的非金属单质;高锰酸钾和浓盐酸反应会产生氯气,氯气具有氧化性,能将溴离子,碘离子氧化为对应的单质,即A处:Cl2+2Br-=2Cl-+Br2,B:Cl2+2I-=2Cl-+I2,故答案为:活泼的非金属单质置换较不活泼的非金属单质;Cl2+2I-=2Cl-+I2。


科目:高中化学 来源: 题型:
【题目】下列影响化学反应速率的因素中,是通过改变活化分子百分数来实现的是( )
①改变气体物质的浓度 ②改变气体的压强
③加入催化剂 ④改变气体的温度
A. 只有①②B. 只有③④C. 只有①③④D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为密闭容器中反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
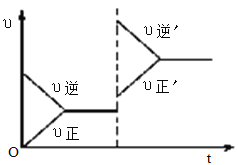
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 新平衡时CO的浓度比原平衡小
D. 改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
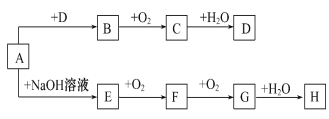
(1)写出下列物质的化学式:A___________。
(2)写出下列反应的化学方程式:
B与E按1:2通入水中_________;
G→H_______
D的浓溶液与红热的木炭反应的方程式:______
(3)检验某溶液中是否含D中阴离子的方法:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是
①用镁条引燃铝、氧化铁混合粉末 ②碳酸钙受热分解 ③浓硫酸稀释
④氢氧化钡晶体和氯化铵固体反应 ⑤生石灰和水反应
A. ②④B. ①④C. ②③D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 常温下pH=7的溶液中:Fe3+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
B. 水电离的c(H+)=1×10-13mol·L-1的溶液:Na+、NH4+、SO![]() 、CO
、CO![]()
C. 含有0.1mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
D. 含有大量NO![]() 的溶液:K+、Fe2+、SO
的溶液:K+、Fe2+、SO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
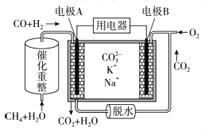
A. 反应CH4+H2O==3H2+CO,每消耗11.2L CH4转移3mol电子
B. 电极B上发生的电极反应为O2+2CO2+4e-==2CO32-
C. 电池工作时,电子通过熔融盐由电极B向电极A移动
D. 电极A上CO参与的电极反应为CO+4OH- —2e- == CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下为无色液体,而且密度大于水的是
①苯 ②硝基苯 ③溴苯 ④四氯化碳 ⑤溴乙烷 ⑥乙酸乙酯
A. ②③④⑤B. ③④⑤⑥C. ①⑥D. ②③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com