
| A、pH大于7的溶液:Na+、Ba2+、SO32-、ClO- |
| B、含有0.1 mol?L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl- |
| C、使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl- |
| D、由水电离产生的c(H+)=10-13mol?L-1的溶液:NH4+、SO42-、NO3-、Cl- |


科目:高中化学 来源: 题型:
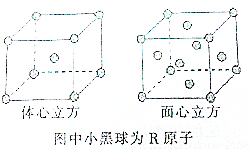 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.查看答案和解析>>
科目:高中化学 来源: 题型:
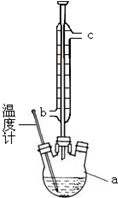 阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:| 浓硫酸摇匀 |
| 85~90℃ |
| 10min |
| 冷却 |
| 15min |
| 抽滤 |
| 洗涤 |
| 加入A |
| 充分搅拌 |
| 抽滤 |
| 盐酸 |
| 冷却 |
| 抽滤 |
| 洗涤 |
| 乙酸乙酯 |
| 沸石 |
| 加热 |
| 回流 |
| 趁热过滤 |
| 冷却 |
| 抽滤 |
| 洗涤 |
| 干燥 |
| 名称 | 相对分子质量 | 熔点或沸点(0C) | 水 | 醇 | 醚 |
| 水杨酸 | 138 | 158(熔点) | 微溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 | 可溶 | 易溶 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 | 可溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
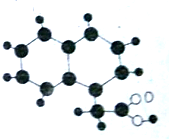 2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图.不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键.下列有关M的推断正确的是( )
2009年《化学教育》期刊封面刊载如图所示的有机物M(只含C、H、O)的球棍模型图.不同大小、颜色的小球代表不同的原子,小球之间的“棍”表示共价键,既可以表示三键,也可以表示双键,还可以表示单键.下列有关M的推断正确的是( )| A、M的分子式为C12H12O2 |
| B、M与足量氢气在一定条件下反应的产物的环上一氯代物有7种 |
| C、M能发生中和反应、取代反应 |
| D、一个M分子最多有11个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B、用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、用稀硝酸清洗银镜反应实验后的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
| D、钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
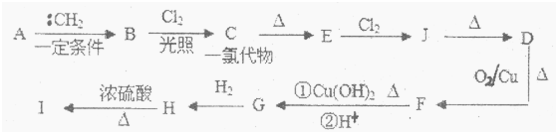
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com