
【题目】下列离子方程式与所述事实相符且正确的是:
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量的CO2制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D. 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2 ![]() Cu(OH)2
Cu(OH)2 ![]() Cu
Cu
C.Al ![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D.MgO(s)![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色变深
B.对于反应2HI(g)![]() H2 (g)+I2(g),达到平衡后,缩小容器的体积可使体系颜色变深
H2 (g)+I2(g),达到平衡后,缩小容器的体积可使体系颜色变深
C.实验室中常用排饱和食盐水的方法收集氯气
D.500℃左右比室温更利于合成氨反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )
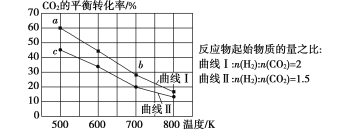
A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知Ⅰ、断裂1 mol N—N吸收167 kJ热量,形成1 mol ![]() 放出942 kJ热量;Ⅱ、N2(g)+3H2(g)
放出942 kJ热量;Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)
2NH3(g) ΔH1=-92 kJ/mol,N4(g)+6H2(g)![]() 4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )
4NH3(g) ΔH2(kJ/mol)根据以上信息和数据,下列说法正确的是( )

A.ΔH2>0B.N2分子比N4分子稳定
C.ΔH2=2ΔH1D.ΔH2与方程式系数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
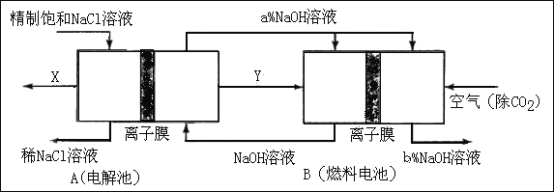
①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体PCl5受热即挥发并发生分解:PCl5(g)![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com