
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
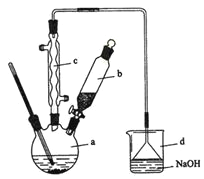
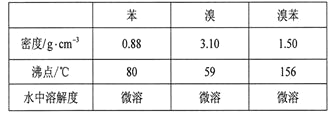
�����кϳɲ���ش����⣺
(1)��a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������__________���塣�����μ���Һ����ꡣװ��d��������__________________________________________��
(2)�÷�Ӧ�Ļ�ѧ����ʽ:__________________________________________��
(3)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������l0 mLˮ��8 mL l0����NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ������dz�ȥHBr��δ��Ӧ��Br2��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����__________________________��
(4)�����Ϸ���������屽�л����е���Ҫ����Ϊ_______��Ҫ��һ���ᴿ�����в����б������______(������ȷѡ��ǰ����ĸ)��
A�ؽᾧ B���� C���� D��ȡ
(5)�ڸ�ʵ���У�a���ݻ����ʺϵ���______(������ȷѡ��ǰ����ĸ)��
A.25 mL B .50 mL C. 250 mL D. 509 mL
���𰸡�HBr ������  ��ˮ����
��ˮ���� ![]() C B
C B
��������
��1��HBr��ˮ��������γɰ���������HBr������������������������Һ����װ��d�����ã�
(2) ���뱽�����������������·���ȡ����Ӧ�����屽���廯�⣻
(3) ��ˮ�Ȼ��ƾ�����ˮ�ԣ��ܸ����屽��
��3�����ݷ�����Ĵ��屽�к���δ��Ӧ�ı������뻥�ܵ�Һ�壬���÷е㲻ͬ���ɲ�������ķ������з��룻
��5��������ȡ�屽���ӵ�Һ�������Լ���Һ�����һ�㲻��������![]() ��������
��������![]() �����
�����
��1������������HBr����ˮ��������γɰ�����HBr������������������������Һ������װ��d���Է�������
(2) ���뱽�����������������·���ȡ����Ӧ�����屽���廯�⣬��Ӧ����ʽ��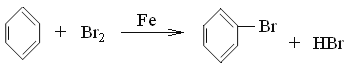 ��
��
(3) ��ˮ�Ȼ��ƾ�����ˮ�ԣ���ֳ��Ĵ��屽�м�����������ˮ�Ȼ��Ƶ�Ŀ������ˮ�������屽��
��4����Ӧ��õ����屽����������δ��Ӧ�ı��������屽���ܣ������ķе�ͣ����Բ�������ķ������з��룬ѡC��
��5�����������У�����a�м���15mL��ˮ������b��С�ļ���4mLҺ̬�壬�����a�м���10mLˮ����Լ30mL������a���ݻ����ʺϵ���50mL����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Sb)����Ȼ��һ�����������ʽ���ڣ��ҹ�����̲���ռ�����һ������������ȡ������һ�������ڸ����½�����ת��Ϊ���������̼��ԭ��2Sb2S3��3O2��6Fe��Sb4O6��6FeS����Sb4O6��6C��4Sb��6CO��������˵����ȷ����(����)
A. ��Ӧ��˵��������Sb��ԭ�Ա�Cǿ
B. ��Ӧ����ÿ����1 mol FeSʱ����ת��2mol����
C. ÿ����1 mol Sbʱ����Ӧ���뷴Ӧ���л�ԭ�������ʵ���֮��Ϊ4�U3
D. ��Ӧ�٢����������ֱ���Sb2S3��Sb4O6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2����Դ����������Ч����CO2�ŷţ��������̼��Դ��
��1��CO2��CH4�����������Ƶúϳ�����CH4(g)��CO2(g)![]() 2CO(g)��2H2(g)
2CO(g)��2H2(g)
��֪��C(s)+2H2(g)=CH4(g) ��H=��75 kJ��mol1
C(s)+O2(g)=CO2(g) ��H=��394 kJ��mol1
C(s)+![]() O2(g)===CO(g) ��H=��111 kJ��mol1
O2(g)===CO(g) ��H=��111 kJ��mol1
�ٸô�������Ӧ����H=____ kJ��mol1�����������CH4ƽ��ת���ʵ�������____�����ţ���
A�����µ�ѹ B�����¸�ѹ C�����¸�ѹ D�����µ�ѹ
��ij�¶��£������Ϊ2 L�������м���2 mol CH4��1 mol CO2�Լ���������������Ӧ���ﵽƽ��ʱCO2��ת������50%����ƽ�ⳣ��Ϊ______mol2��L2�����п��жϸ÷�Ӧ�ﵽƽ�����_________�����ţ���
A����λʱ��������n mol��CH4��ͬʱ����n mol��H2 B��v(CH4):v(CO)=1:2
C�������л��������ܶȲ��ٷ����仯 D�������е�ѹǿ���ֲ���
��2��CO2���Ա�(NH4)2CO3��Һ����ӦΪ(NH4)2CO3(aq)��H2O(l)��CO2(g)=2NH4HCO3(aq)����H��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2����(�õ�����Ϊϡ�ͼ�)����tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ����ϵ��ͼ1������H______(�>������������<��)0��
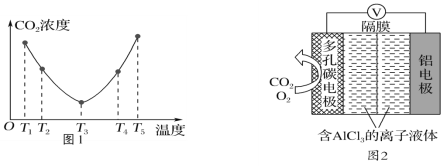
��3��O2������Al-CO2��ع���ԭ����ͼ2��ʾ���õ�ص�����������Ч����CO2����ط�Ӧ����Al2(C2O4)3����Ҫ�Ļ���ԭ�ϡ�
��صĸ�����Ӧʽ��________________________________��
��ص�������Ӧʽ��6O2��6e��=6O��6CO2��6O=3C2O42-��6O2
��Ӧ������O2��������_________________��
��4��CO2���Ա�NaOH��Һ������������Һc(HCO3-)��c(CO32-) �� 2��1����ҺpH��________��(�����£�H2CO3��K1��4��10��7��K2��5��10��11)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʵ�����������ķ�Ӧ��Zn+2HCl= ZnCl2+H2��������13.0gZn����һ����2mol/Lϡ�����ַ�Ӧ��һ��ʱ���Zn����ʣ��.
(1)��˫���Ż����ű������ת�Ƶķ������Ŀ
(2)�Ƚ�H+��Zn2+������ǿ��
(3)������������������������
(4)����ZnCl2�����ʵ���Ϊ���٣�
(5)��״���£�������ռ������������壿
(6)��Ӧ��ת�Ƶĵ��ӵĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȲΪ��Ҫԭ�Ͽ��Ժϳɾ�����ϩ���۱�ϩ����ȶ�����ͼ��ʾ���йغϳ�·��ͼ��
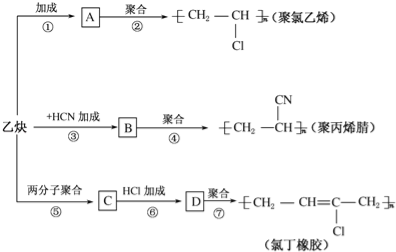
��֪��Ӧ��nCH2�TCH��CH�TCH2![]()
![]()
��������и��⣺
��1��д�����ʵĽṹ��ʽ��A ��C ��
��2��д����Ӧ�Ļ�ѧ����ʽ
��Ӧ���� ��
��Ӧ���� ��
��Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڣ�50��ʱҺ���д���������ƽ�⣺2NH3(Һ)![]() NH4+��NH2-���������ӵ�ƽ��Ũ�Ⱦ�Ϊ1.0��10��15mol��L��1�������йأ�50��ʱ���ӻ�����������ȷ����(����)
NH4+��NH2-���������ӵ�ƽ��Ũ�Ⱦ�Ϊ1.0��10��15mol��L��1�������йأ�50��ʱ���ӻ�����������ȷ����(����)
A. ���ӻ�Ϊ1.0��10��15
B. ���ӻ�Ϊ1.0��10��30
C. ��Һ���м��백����(NaNH2)��Һ�������ӻ�����
D. ��Һ���м���NH4Cl��c(NH4+)�������ӻ�����ֵҲ��֮����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
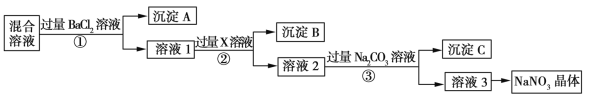
����Ŀ������NaCl��Na2SO4��NaNO3�Ļ���ѡ���ʵ����Լ���ȥ���ʣ��Ӷ��õ�������NaNO3���壬��Ӧ��ʵ��������ͼ��ʾ��
��ش��������⣺
��1��д��ʵ���������������ʵĻ�ѧʽ���Լ�X__������A___��
��2������ʵ�������Т٢ڢ۲���Ҫ���е�ʵ�������__����������ƣ���
��3������ʵ�������м������Na2CO3��Һ��Ŀ����__________��
��4������ʵ�鷽���õ�����Һ3�п϶�����____���ѧʽ�����ʡ�Ϊ�˽��������⣬��������Һ3�м���������__���ѧʽ����
��5���ڢٲ����������֤���ӵ�BaCl2��Һ�ѹ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������7�����ʣ���NaHCO3��CH3COOH��BaSO4����HF����C2H5OH����Al����ʳ��ˮ.��������ǿ����ʵ��� ������ţ���ͬ�������ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ���� ��
II������һƿŨ��Ϊ0.2mol/L��ij����Һ������Ϊ���ᡢ���ᡢ�����е�һ�֣�Ϊ��ȷ��������Һ����ɽ���ʵ�飺ȡ20.00mL������Һ����μ���0.2mol/L������������Һ��ǡ�÷�Ӧ��ȫʱ�����Һ���Ϊ20.00mL�����û�ѧ����ش�
��1����������� ��
��2����pH��ֽ��÷�Ӧ��������Һ�ʼ��ԣ����ݴ�����˵��������ҺΪ �������ӷ���ʽ˵����Һ�ʼ��Ե�ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ���ʽ3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O���ش��������⣺
��1����˫���ŷ���ʾ���ӵ�ת�Ƶķ�����Ŀ_______��
��2���÷�Ӧ�е���������________������������________��
��3���÷�Ӧ��������Ũ�����������________��_______��
��4�������Ϊ���ӷ�Ӧ����ʽ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com