
| A、5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| B、14g乙烯、丙烯的混合气体含有C-H数为2NA |
| C、标准状况下,4.48L重水(D2O)中含有的中子数为2NA |
| D、向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA |
| m |
| M |
| m |
| M |
| 14g |
| 14g/mol |


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
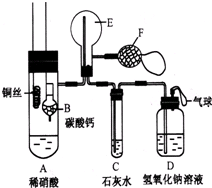 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个信号,强度之比为1:1 |
| B、三个信号,强度之比为1:1:1 |
| C、两个信号,强度之比为3:1 |
| D、三个信号,强度之比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
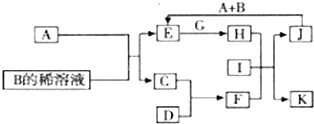 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com