
【题目】请回答下列问题:
(1)某元素X基态原子的最外层有3个未成对电子,次外层有2个电子,其价电子排布图为___,其原子核外有___种不同运动状态的电子;其最低价氢化物电子式为___,中心原子采用___杂化,分子立体构型为___。
(2)某元素Y基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其元素名称为___,Y+的外围电子排布式为___,该元素固体单质常常采用___堆积方式,配位数为___,空间利用率为___。
【答案】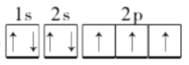 7
7 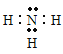 sp3 三角锥形 铜 3d10 面心立方最密 12 74%
sp3 三角锥形 铜 3d10 面心立方最密 12 74%
【解析】
(1)X元素基态原子的最外层有三个未成对电子,次外层有2个电子,根据构造原理可知,该元素是N元素;
(2)由元素Y基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,根据构造原理可知,Y为铜元素。
(1)由元素X基态原子的最外层有3个未成对电子,次外层有2个电子,根据构造原理可知,X为N元素,电子排布式为1s22s22p3,电子排布图为![]() ,由核外电子排布规律可知,核外没有运动状态完全相同的电子,则氮原子核外有7种不同运动状态的电子;氮元素最低价氢化物的分子式为NH3,NH3为共价化合物,电子式为
,由核外电子排布规律可知,核外没有运动状态完全相同的电子,则氮原子核外有7种不同运动状态的电子;氮元素最低价氢化物的分子式为NH3,NH3为共价化合物,电子式为![]() ,NH3分子中N原子的价层电子对数为4,孤对电子对数为1,则N原子采用的杂化方式为sp3杂化,NH3的分子立体构型为三角锥形,故答案为:
,NH3分子中N原子的价层电子对数为4,孤对电子对数为1,则N原子采用的杂化方式为sp3杂化,NH3的分子立体构型为三角锥形,故答案为: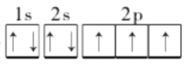 ;7;
;7;![]() ;sp3;三角锥形;
;sp3;三角锥形;
(2)由元素Y基态原子的M层全充满,N层没有成对电子,只有一个未成对电子可知,Y为铜元素,电子排布式为1s22s22p63s23p63d104s1,Cu失去1个电子形成Cu+离子,Cu+的外围电子排布式为3d10;铜单质为金属晶体,晶体的堆积方式是面心立方最密堆积,配位数是12,空间利用率为74%,故答案为:铜;3d10;面心立方最密; 12;74%。


科目:高中化学 来源: 题型:
【题目】在刚性容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g),一定压强下,平衡时H2的转化率α(H2)随温度T、投料比
C2H5OH(g)+3H2O(g),一定压强下,平衡时H2的转化率α(H2)随温度T、投料比![]() 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
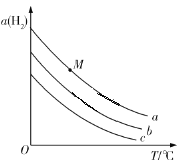
A.投料比![]() 的大小关系是:a>b>c
的大小关系是:a>b>c
B.图中M点对应的平衡,若容积不变,充入He,则α(H2)不变
C.该反应的平衡常数K(600 ℃)>K(500 ℃)
D.若题图表示相同投料时,不同压强下α(H2)随T的变化关系,则压强最大的是a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,1小时后观察到生铁明显锈蚀,由此得出的结论是
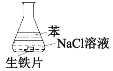
A.属于化学腐蚀
B.O2未参与反应
C.负极反应2Fe-6e+3H2O→Fe2O3+6H+
D.正极反应O2+4e- +2H2O→4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等
B.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.苯乙烯和甲苯分子内所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是_____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类机物开始出现同分异构休。
(Ⅱ)已知有机物A~F有如图转化关系:
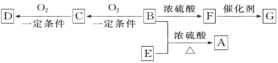
已知:①2CH3CHO+O2![]() 2CH3COOH+2H2O;
2CH3COOH+2H2O;
②CH3CH2OH![]() CH2=CH2↑+H2O(该反应属于消去反应)。
CH2=CH2↑+H2O(该反应属于消去反应)。
③A的分子式为C10H20O2; ④B分子中含2个甲基;⑤D、E互为具有相同官能团的同分异构体,D能与碳酸氢钠反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种;⑥F可以使溴的四氯化碳溶液褪色,G为高分子化合物。请填写以下空白:
(1)B可以发生的反应有_____(填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D分子所含有的官能团的名称是________。
(3)写出与D、E具有相同官能团的同分异构体(D、E除外)可能的结构简式______。
(4)写出下列转化的化学方程式:
B+E→A:_______;
B→C:___________;
F→G:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
![]()
化学位移5
下列关于该有机物的叙述正确的是
A. 该有机物属于芳香族化合物
B. 键线式中的Et代表的基团为-CH3
C. 该有机物不同化学环境的氢原子有8种
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B. 香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(![]() ) 的一氯代物有5种(不含立体异构)
) 的一氯代物有5种(不含立体异构)
D. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
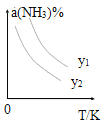
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:
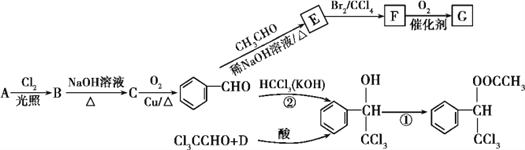
已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体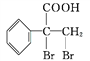 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com