
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
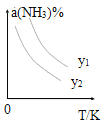
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
【答案】< 低温 < abd 40500 ![]() mol L-1min-1 48 正反应方向 AD
mol L-1min-1 48 正反应方向 AD
【解析】
Ⅰ、(1)通过图象分析温度升高,氨气转化率的变化从而分析反应吸放热;自发进行的判断依据是△H-T△S<0,结合反应特征分析判断需要的条件;若y表示反应开始时的水碳比,升温平衡逆向进行,氨气转化率减小,一定温度下,水和二氧化碳之比越大,平衡逆向进行,氨气转化率越小,则y1小于y2;
(2)平衡时是正逆反应速率相同,各组分含量保持不变,原则是变量不变分析选项;
II.①根据v逆=kc(CO)c3(H2)计算k的值;
②根据![]() 求出反应速率;根据
求出反应速率;根据![]() 计算平衡常数;通过浓度商与平衡常数的比较判断反应移动方向;
计算平衡常数;通过浓度商与平衡常数的比较判断反应移动方向;
III.可能发生的反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH的物质的量为0.2L×0.15mol/L=0.03mol,先分析0.02mol CO2通入之后溶液的溶质,再进行判断;
Ⅰ、(1)图象分析得到温度升高,氨气转化率减小说明平衡逆向进行,正反应为放热反应,所以ΔH<0;自发进行的判断依据是△H-T△S<0,该反应ΔH<0,△S<0,所以需要低温条件才能自发进行;压强越大平衡正向进行,氨气转化率增大,若y表示压强,则一定温度下y1大于y2,若y表示反应开始时的水碳比,升温平衡逆向进行,氨气转化率减小,一定温度下,水和二氧化碳之比越大,平衡逆向进行,氨气转化率越小,则y1小于y2;
故答案为:<;低温;<;
(2)a.生成物有固体,利用极限法考虑,反应初始和彻底进行平均相对分子质量不同,混合气体的平均相对分子质量保持不变时说明平衡不再移动,故正确;
b.反应达到平衡各组分体积分数不变,CO2和NH3的体积分数保持不变说明平衡,故正确;
c.反应加入一定量的 NH3和CO2,若按2:1加入,则二者转化率始终相等,若不按2:1加入,二者转化率不可能相等,故CO2和NH3的转化率相等不能说明平衡,故错误;
d.混合气体体积不变,平衡右移时有固体生成,气体体积减小,即密度减小,所以混合气体的密度保持不变说明反应平衡,故正确;
e.一个氨气分子中有3个N—H键,2molN—H键断裂即2/3mol氨气反应,1molCO2生成的同时有 2molN—H键断裂时正反应速率和逆反应速率不相等,故错误;
故答案为:abd;
(3)①根据v逆=kc(CO)c3(H2),由表中数据,c13=![]() mol3/L3,则c2=
mol3/L3,则c2=![]() mol/L=0.2mol/L,所以k=
mol/L=0.2mol/L,所以k=![]() L3mol3min1=40500L3mol3min1,
L3mol3min1=40500L3mol3min1,
故答案为:40500;
②设转化的CH4为amol/L,容器体积为3L,则初始c(CH4)=3mol/3L=1mol/L,c(H2O)=3mol/3L=1mol/L,列三段式
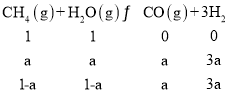
氢气的体积分数为![]() =60%,解得a=2/3mol/L,则v(CH4)=
=60%,解得a=2/3mol/L,则v(CH4)=![]() =
= ![]() mol L-1min-1;平衡常数
mol L-1min-1;平衡常数![]() =
= =48;平衡后再向容器中加入1 mol CH4和1 mol CO,此时浓度商Q=
=48;平衡后再向容器中加入1 mol CH4和1 mol CO,此时浓度商Q= ,所以反应向正反应方向移动,
,所以反应向正反应方向移动,
故答案为:40500;![]() mol L-1min-1;48;正反应方向;
mol L-1min-1;48;正反应方向;
III.可能发生的反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,NaOH的物质的量为0.2L×0.15mol/L=0.03mol,1<n(NaOH):n(CO2)=3:2<2,则反应得到Na2CO3、NaHCO3混合溶液,设二者物质的量分别为xmol、ymol,则![]() ,解得x=y=0.01,即溶液中的溶质为Na2CO3和NaHCO3;
,解得x=y=0.01,即溶液中的溶质为Na2CO3和NaHCO3;
A.溶液显碱性,且碳酸根的水解程度大于碳酸氢根的电离程度,所以溶液中存在:c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+),A项正确;
B.根据物料守恒可知2c (Na+)=3[c(CO32-)+ c(HCO3-)+ c(H2CO3)],B项错误;
C.根据电荷守恒可知c (Na+)+c(H+)=c(HCO3-)+ 2c(CO32-)+c(OH-),C项错误;
D.电荷守恒和物流守恒联立消去钠离子即得c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)(质子守恒),故D项正确;
故答案为:AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)某元素X基态原子的最外层有3个未成对电子,次外层有2个电子,其价电子排布图为___,其原子核外有___种不同运动状态的电子;其最低价氢化物电子式为___,中心原子采用___杂化,分子立体构型为___。
(2)某元素Y基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其元素名称为___,Y+的外围电子排布式为___,该元素固体单质常常采用___堆积方式,配位数为___,空间利用率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究AgNO3溶液与Na2SO3溶液的反应。
实验I | 操作 | 现象 |
| 滴加5滴0.1mol/L Na2SO3溶液,振荡 | 产生白色沉淀,测得混合溶液pH=5 |
继续滴加0.1mol/L Na2SO3溶液,振荡 | 白色沉淀增多,继续滴加,白色沉淀消失,测得混合溶液pH=9 |
资料:Ag2SO3,白色固体,难溶于水;Ag2SO4,白色固体,微溶于水;AgOH,白色固体,常温下不稳定,易分解产生棕褐色固体。
(1)测得0.1mol/L Na2SO3溶液pH=10,用离子方程式解释原因:_______。
(2)实验小组对白色沉淀的成分提出猜想:
①可能含Ag2SO3。
②可能含Ag2SO4,理由是________。
③可能含AgOH。
实验产生的白色沉淀放置一段时间后未发生明显变化,排除猜想③。
(3)检验白色沉淀的成分
(资料:Ag++2S2O32![]() Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
Ag(S2O3)23,Ag(S2O3)23在溶液中稳定存在。)
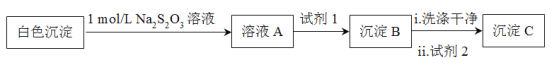
测得沉淀C质量小于沉淀B,试剂1和试剂2分别是_____、______,说明白色沉淀是Ag2SO3和Ag2SO4的混合物。
(4)探究白色沉淀消失的原因。实验小组设计对照实验:
实验II | 实验III | |
实验操作 |
|
|
现象 | 沉淀溶解 |
① 补充实验III的实验操作及现象:_______,证明SO32使白色沉淀溶解。
② 查阅资料:Ag2SO3能溶于过量Na2SO3溶液中形成Ag(SO3)23。白色沉淀中含有g2SO4,但还能全部溶解于Na2SO3溶液的原因是______。
(5)探究AgNO3溶液与Na2SO3溶液能否发生氧化还原反应。
实验IV | 操作 | 现象 |
| 步骤i:滴加一定体积0.1 mol/L Na2SO3溶液 | 产生白色沉淀 |
步骤ii:再加入NaOH溶液调pH=14,振荡 | 白色沉淀变黑,经检验为Ag |
步骤ii中Ag2SO3发生反应的离子方程式是_________。
(6)综合实验I和IV,说明AgNO3溶液与Na2SO3溶液的反应类型与_______有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的这类香料:
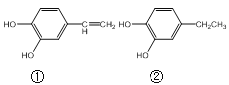

则下列说法正确的是( )
A.①与溴水反应后,溴水褪色说明分子中含有碳碳双键
B.③④相对质量相同,所以它们的质谱图相同
C.等物质的量的上述物质与足量的Na反应,产生氢气的量相同
D.1mol②与足量的溴水反应,消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是

A. 元素的非金属性: X>R>W
B. 简单离子的半径:W>R>X
C. X与W形成的化合物中只有共价键
D. X与Z形成的化合物中只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )

A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿![]() 主要成分为
主要成分为![]() ,另含少量铁,钙,铜等金属化合物
,另含少量铁,钙,铜等金属化合物![]() 作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的![]() ,又制得电池材料
,又制得电池材料![]() 反应条件已省略
反应条件已省略![]()
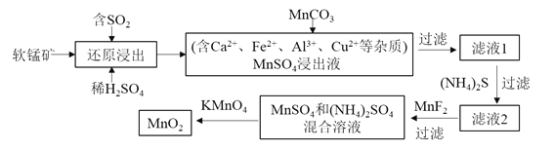
请回答下列问题:
![]() 上述还原浸出是脱硫过程,实现了 ______
上述还原浸出是脱硫过程,实现了 ______ ![]() 选填编号
选填编号![]() .
.
![]() 废气物的综合利用
废气物的综合利用
![]() 臭氧层空洞的减少
臭氧层空洞的减少
![]() 白色污染的减少
白色污染的减少
![]() 酸雨的减少
酸雨的减少
![]() 写出上述软锰矿经还原浸出生成
写出上述软锰矿经还原浸出生成![]() 的化学方程式是 ______ .
的化学方程式是 ______ .
![]() 用
用![]() 能除去还原浸出液中的
能除去还原浸出液中的![]() ,请用离子方程式解释其原因是 ______ .
,请用离子方程式解释其原因是 ______ .
![]() 加入
加入![]() 的目的主要是除去 ______ ;加入
的目的主要是除去 ______ ;加入![]() 的目的主要是除去 ______ ;
的目的主要是除去 ______ ;![]() 填离子符号
填离子符号![]()
![]() 下列各组试剂中,能准确测定一定体积燃煤尾气中
下列各组试剂中,能准确测定一定体积燃煤尾气中![]() 含量的是 ______
含量的是 ______ ![]() 填编号
填编号![]()
a.NaOH溶液、石蕊试液
b.稀![]() 酸化的
酸化的![]() 溶液
溶液
c.碘水、淀粉溶液
d.氨水、石蕊试液
![]() 用电化学法模拟工业处理
用电化学法模拟工业处理![]() 将硫酸工业尾气中的
将硫酸工业尾气中的![]() 通入如图装置
通入如图装置![]() 电均为惰性材料
电均为惰性材料![]() 进行实验,可用于制备硫酸,同时获得电能:
进行实验,可用于制备硫酸,同时获得电能:
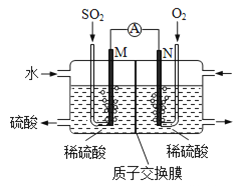
![]() 极发生的电极反应式为 ______ .
极发生的电极反应式为 ______ .
![]() 若使该装置的电流强度达到
若使该装置的电流强度达到![]() ,理论上每分钟应向负极通入标准状况下气体的体积为 ______
,理论上每分钟应向负极通入标准状况下气体的体积为 ______ ![]() 保留3位小数,已知:1个
保留3位小数,已知:1个![]() 所带电量为
所带电量为![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
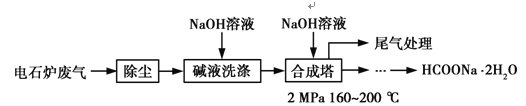
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com