
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
【答案】B
【解析】
A. 3He的中子数为3-2=1,则3g3He的中子数为3g÷3g/mol×NA/mol=1NA,故A正确;
B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1 L 0.1 mol·L1的磷酸钠溶液中磷酸根离子的个数小于1 L× 0.1 mol·L1×NA =0.1NA,故B错误;
C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3。1mol重铬酸钾中含2molCr原子,故转移的电子数为1mol×2×3×NA/mol=6NA,故C正确;
D. 常温下,11g CO2所含的共用电子对数目为11g÷44g/mol×4×NA /mol= NA,故 D正确;
故选:B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
2CO2(g)+2H2O(g) ΔH= 1411.3 kJ·mol1
C.用石墨电极电解1 L 0.1 mol·L1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在刚性容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g),一定压强下,平衡时H2的转化率α(H2)随温度T、投料比
C2H5OH(g)+3H2O(g),一定压强下,平衡时H2的转化率α(H2)随温度T、投料比![]() 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
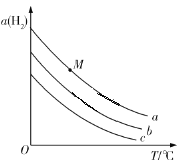
A.投料比![]() 的大小关系是:a>b>c
的大小关系是:a>b>c
B.图中M点对应的平衡,若容积不变,充入He,则α(H2)不变
C.该反应的平衡常数K(600 ℃)>K(500 ℃)
D.若题图表示相同投料时,不同压强下α(H2)随T的变化关系,则压强最大的是a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是第三周期部分元素的电离能数据,下列说法正确的是( )
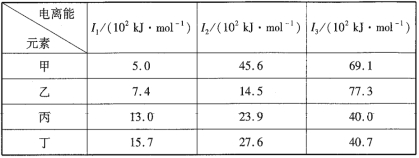
A.甲的金属性比乙弱B.乙的最高正化合价为+1
C.丙一定为非金属元素D.丁一定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( )
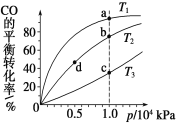
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)>M(c) M(b)>M(d)
D.平衡常数:K(a)<K(c) K(b)=K(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是( )
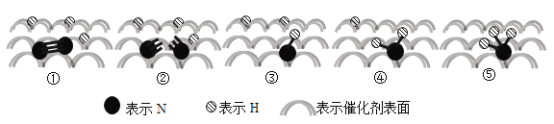
N2(g)+3H2(g)![]() 2NH3(g) △H = 92 kJ/mol
2NH3(g) △H = 92 kJ/mol
A.升高温度不能提高一段时间内NH3的产率
B.图①→②过程吸热,图②→③过程放热
C.N2在反应过程中三键均发生断裂
D.反应过程中存在NH、NH2等中间产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,1小时后观察到生铁明显锈蚀,由此得出的结论是
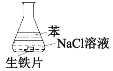
A.属于化学腐蚀
B.O2未参与反应
C.负极反应2Fe-6e+3H2O→Fe2O3+6H+
D.正极反应O2+4e- +2H2O→4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等
B.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.苯乙烯和甲苯分子内所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 和CH4是常见的化合物,同时也是常用的化工原料。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g) + CO2(g) ![]() CO(NH2)2(s) + H2O(g)。
CO(NH2)2(s) + H2O(g)。
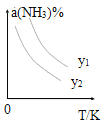
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。
①该反应的ΔH_____0(填“>” 或、“<” ),该反应自发进行的条件是_______________ (填“低温”“高温”或“任意温度”) 若y表示反应开始时的氨碳比[![]() ],则y1________y2。(填“>”、“<”或“=”);
],则y1________y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的 NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是________ (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时有 2molN—H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2,:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ΔH = + 203 kJmol-1
CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.1 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数k为____L3mol-3min-1。
②某温度下,在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)=________;该温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02mol CO2通入200mL 0.15mol/L的/span>NaOH溶液中,充分反应后下列关系式中正确的是_____________________
A.c(Na+)>c(HCO3-)> c(CO32-)>c(OH-)>c(H+)
B.3c (Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
C.c (Na+)+c(H+)=c(HCO3-)+ c(CO32-)+c(OH-)
D.c(HCO3-)+ 3c(H2CO3)+2c(H+)= c(CO32-)+2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com