
【题目】碳酸镧咀嚼片是一种不含钙和铝的磷酸盐结合剂,用于慢性肾衰患者高磷血症的治疗。碳酸镧可由 LaCl3 为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[La(OH)CO3]。
(1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。
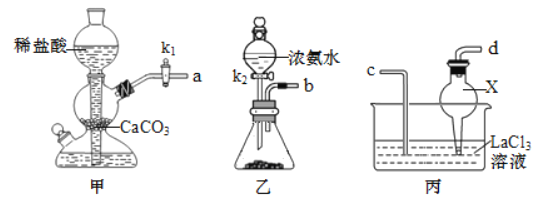
①仪器 X 的名称为________;检验装置甲气密性良好的方法是___________。
②实验中 K1、 K2 打开的先后顺序为________;为保证碳酸镧的纯度,实验过程中需要注意的问题有____________。
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为_______和____________。
②选择碳酸氢钠溶液制备碳酸镧的优点是___________(任写一条)。
③T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1, HCO3-的电离平衡常数为 6.0×10-11。请计算反应 2LaCl3+3NaHCO3![]() La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
La2(CO3)3↓+3NaCl+3HCl 的平衡常数 K=_________。
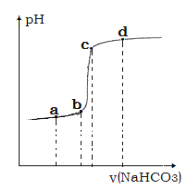
④利用手持技术测定溶液的 pH 从而监控反应过程,得到如图曲线。请说明 bc 段变化的原因__________。
(3)碳酸镧(式量为 458)质量分数的测定:准确称取15.0g产品试样,溶于10.0mL 稀盐酸中,加入 10mLNH3-NH4Cl 缓冲溶液,加入 0.2g 紫脲酸铵混合指示剂,用 0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-= LaY-+2H+),消耗 EDTA 溶液 60.00mL。则产品中碳酸镧的质量分数 w=________。
【答案】 球形干燥管 关闭活塞 K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好 先打开 K2 再打开 K1 控制氨气(或CO2)通入量 2La2+ +3HCO3- = La 2(CO3)3+3H+ H++HCO3- =CO2+H2O 碳酸氢钠碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3] 200 La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃 91.6%
【解析】(1)①仪器 X 的名称为球形干燥管;检验装置甲气密性良好的方法是关闭活塞 K1,向球形漏斗中加水至漏斗内外形成液面差,一段时间后,液面差保持不变,说明气密性良好;②氨气是极易溶于水的气体,先通氨气,在碱性条件下再通入二氧化碳,溶解的量较大,故实验中先打开 K2 再打开 K1;为保证碳酸镧的纯度,实验过程中需要控制氨气(或CO2)通入量;(2)①碳酸氢钠分别与和La2+、H+反应,过程中会发生两个平行反应的离子方程式为2La2+ +3HCO3- = La 2(CO3)3+3H+和H++HCO3- =CO2+H2O;②选择碳酸氢钠溶液制备碳酸镧的优点是碳酸氢钠碱性相对较弱,可防止生成碱式碳酸镧[La(OH)CO3];③2LaCl3+3NaHCO3![]() La2(CO3)3↓+3NaCl+3HCl 的离子反应方程式为2La2+ +3HCO3- = La 2(CO3)3↓+3H+,T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1,则饱和溶液中c(La2+)=2c[La 2(CO3)3]= 2.0×10-7 mol·L-1,c(CO32-)=3c[La 2(CO3)3]= 3.0×10-7 mol·L-1,Ksp[La 2(CO3)3]= c2(La2+) c3(CO32-)=(2.0×10-7 mol·L-1)2×(3.0×10-7 mol·L-1)3=1.08×10-33,HCO3-的电离平衡常数为 6.0×10-11,则反应的平衡常数 K=
La2(CO3)3↓+3NaCl+3HCl 的离子反应方程式为2La2+ +3HCO3- = La 2(CO3)3↓+3H+,T℃时,碳酸镧的溶解度为1.0×10-7 mol·L-1,则饱和溶液中c(La2+)=2c[La 2(CO3)3]= 2.0×10-7 mol·L-1,c(CO32-)=3c[La 2(CO3)3]= 3.0×10-7 mol·L-1,Ksp[La 2(CO3)3]= c2(La2+) c3(CO32-)=(2.0×10-7 mol·L-1)2×(3.0×10-7 mol·L-1)3=1.08×10-33,HCO3-的电离平衡常数为 6.0×10-11,则反应的平衡常数 K=![]() ;④利用手持技术测定溶液的 pH 从而监控反应过程,La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃,bc 段变化如图曲线;(3)滴定时消耗 EDTA 溶液的物质的量为60.00mL×10-3L/mL×0.5 mol/L=0.03mol,根据反应La3++H2Y2-= LaY-+2H+可知,产品中碳酸镧的质量分数 w=
;④利用手持技术测定溶液的 pH 从而监控反应过程,La3+完全沉淀, 再滴入碳酸氢钠,水解使溶液的碱性增强,pH发生突跃,bc 段变化如图曲线;(3)滴定时消耗 EDTA 溶液的物质的量为60.00mL×10-3L/mL×0.5 mol/L=0.03mol,根据反应La3++H2Y2-= LaY-+2H+可知,产品中碳酸镧的质量分数 w=![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分离下列三组混合物依次采取的方法正确的是:①碳酸钙和氯化钙的溶液 ②植物油和氯化钠溶液 ③氯化钠溶液和鸡蛋清( )
A.渗析、蒸馏、萃取
B.分液、萃取、蒸馏
C.过滤、分液、聚沉
D.过滤、分液、渗析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,铁元素被氧化的是( )
A.FeS+2HCl=FeCl2+H2S↑
B.Fe+H2SO4=FeSO4+H2↑
C.FeO+2HCl=FeCl2+H2O
D.Fe2O3+3CO=2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室中常用KClO3在MnO2催化下受热分解制取氧气,反应方程式为_____________。反应后,若想将混合物分离,可先加适量水,充分搅拌,_____________(填实验操作名称)可得MnO2,该实验操作所需的玻璃仪器为___________________________;将剩余部分通过____________(填实验操作名称)可得KCl。
(2)单质碘在水中溶解度较小,在CCl4中溶解度较大,为富集碘单质,可将碘水和CCl4加入到___________(填仪器名称)中,充分震荡后静置,下层溶液呈_________色,___________________________(填具体操作步骤),即可得到相对浓度较大的碘溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
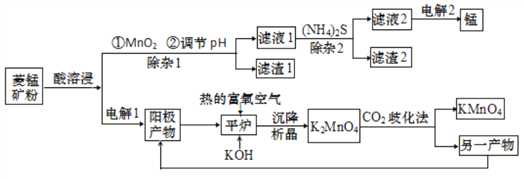
【题目】锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
已知 25 ℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。
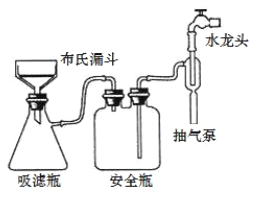
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是
A. Na与水反应时增大水的用量
B. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C. Fe与稀硫酸反应制取氢气时,改用浓硫酸
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是

A. 图⑤所示装置中盛有饱和NaOH溶液用以除去CO2中含有的少量HCl气体
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图①和②所示装置进行粗盐提纯
D. 用图④所示装置可把由5种沸点相差较大的液体组成的混合物中的成分一一分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com