
【题目】两个恒容容器中分别发生反应A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1减小,α2增大 B. α1、α2均增大
C. α1、α2均减小 D. α1增大,α2减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
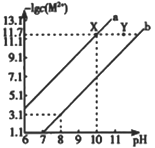
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为_________。
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→_____→尾气处理装置(仪器可重复使用)。
③实验前先通入一段时间N2,其目的为__________________。
④实验证明了气体产物中含有CO,依据的实验现象为_____________。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为____________________。
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为______________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为______________;步骤3中加入锌粉的目的为_______。
(5)草酸亚铁晶体样品的纯度为________;若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T______100℃ (填“大于”或“小于”),判断理是_______________________________
b:温度T时反应的平衡常数K2为__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是

A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知岩脑砂的主要成分为NH4Cl,实验室可通过过量氨气和氯气反应制NH4Cl。
I.实验室制NH4Cl

(1)写出B中反应的离子方程式_________________________________。
(2)为使氨气和氯气在D中充分混合并反应,上述装置的连接顺序为a→d→c_____、______←j←i←h←g←b;写出D中反应的化学方程式_________________________________。
(3)若要检验NH4Cl,除蒸馏水、稀HNO3、AgNO3溶液、红色石蕊试纸外还需要的试剂为___________。
Ⅱ:天然岩脑砂中NH4Cl,纯度的测定(杂质不影响NH4Cl纯度测定)
已知:2NH4 C1+3CuO![]() 3Cu+2HC1↑+N2↑+3H2O
3Cu+2HC1↑+N2↑+3H2O
实验步骤:①准确称取1.19g岩脑砂。②将岩脑砂与足量氧化铜混合加热(装置如下)。

(1)连接仪器,检查装置气密性:先将K中装入水,然后加热G,______________________,则气密性良好。
(2)H中浓硫酸的作用是_________________________________。
(3)实验结束后,恢复至原温,通过K测得气体体积为224mL(换算为标准状况),则天然岩脑砂中NH4C1的纯度为___________。(保留三位有效数字)
(4)某同学通过测I的增重来计算天然岩脑砂中NH4C1的质量分数,则所得NH4C1的纯度___________。(填“偏高”、“偏低”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】页岩气是从页岩层中开采出来的天然气,是一种重要的非常规天然气资源。我国的页岩气储量超过其他任何一个国家,可采储量有1275万亿立方英尺。这些储量足够中国使用300多年,有关页岩气的叙述错误的是
A. 页岩气属于清洁能源 B. 页岩气属于一次能源
C. 页岩气属于一种新能源 D. 页岩气属于不可再生能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com