
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T______100℃ (填“大于”或“小于”),判断理是_______________________________
b:温度T时反应的平衡常数K2为__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________
【答案】大于 0.001 0.36mol/L 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 1.28mol/L 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
【解析】
(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0-60s秒时段,N2O4浓度变化为0.1-0.04=0.06 mol/L,反应速率v(N2O4)=0.06/60=0.0010 mol·L-1·s-1;反应的平衡常数K1为c2(NO2)/c(N2O4)=(0.12)2/0.04=0.36 mol/L;综上所述,本题答案是:大于 ;0.001 ;0.36mol/L。
(2)a. N2O4浓度降低,说明平衡向正反应方向移动,因为正反应方向吸热,所以T>100℃;综上所述,本题答案是:大于;反应正方向吸热,反应向吸热方向进行,故温度升高。
b.平衡时,c(NO2)=0.12+0.0020×10×2=0.16 mol/L,c(N2O4)=0.04-0.0020×10=0.02 mol/L,反应的平衡常数K2为c2(NO2)/c(N2O4)= (0.16)2/0.02=1.28 mol/L;综上所述,本题答案是:1.28mol/L。
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,即平衡向逆反应方向移动;综上所述,本题答案是:逆反应;对气体分子数增大的反应,增大压强平衡向逆反应方向移动。


科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。

(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
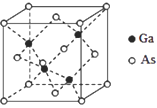
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol·L-1,放出热量b kJ,B中C的浓度分别为
mol·L-1,放出热量b kJ,B中C的浓度分别为![]() mol·L-1,放出热量c kJ。请回答下列问题:
mol·L-1,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小:ω1_____ω2(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500℃时达到平衡后C的浓度为ω3 mol·L-1,则ω1、ω3的关系为_____。
(5)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个恒容容器中分别发生反应A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1减小,α2增大 B. α1、α2均增大
C. α1、α2均减小 D. α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
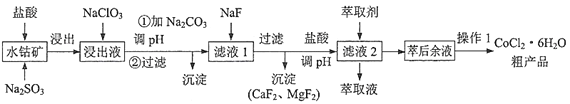
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
②部分阳离子开始沉淀和完全沉淀的pH见下表

③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出Co2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
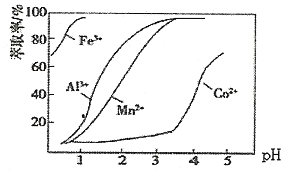
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2·6H2O常用减压烘干法烘干,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )

A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1molS与足量Fe反应,转移的电子数为3NA个
B.1.5 mol NO2与足量H2O反应,转移的电子数为2NA个
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA个
D.100 ml 0.10mol /L的氨水中,含NH3·H2O 分子0.01NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com