
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
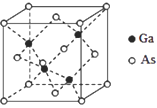
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
【答案】第四周期第Ⅷ族 3s23p4 As>Se>Ga sp3 三角锥形 均为原子晶体,且GaN中N原子半径小,Ga-N 键长比Ga-As短,键能更大,熔点更高 CCl4、SiCl4、 SiF4、 CF4(填其中一种即可) 正四面体形 ![]() ×1010
×1010
【解析】
(1)镍是28号元素,根据构造原理,可确定Ni、S的核外电子排布式,结合原子结构与元素在元素周期表的位置关系确定其在周期表中的位置;一般情况下,同一周期的元素原子序数越大,元素的第一电离能就越大,但当原子核外电子处于其轨道上的全满、半满、全空时是稳定结构,比相应原子序数大1个的VIA的元素大分析。
(2)根据As原子最外层电子数及形成化学键的关系分析Na3As3中As原子的杂化方式;AsCl3的空间构型要根据成键电子对与孤对电子分析其空间构型;
(3)GaAs根据微粒间的作用力与微粒半径大小分析物质熔点高低;
(4)根据等电子体的概念分析其相应的等电子体;
(5)根据微粒的空间构型及相对位置分析其空间构型,用均摊法先计算晶胞中含有的As、Ga原子数目,计算出晶胞的质量,结合晶胞的密度可得晶胞的体积。
(1)镍是28号元素,根据构造原理,可确定Ni核外电子排布式是1s22s22p63s23p63d84s2,在元素在元素周期表的位置为第四周期第Ⅷ族;S原子的价电子排布式为1s22s22p4;一般情况下,同一周期的元素原子序数越大,元素的第一电离能就越大,但As原子核外最外层的4p轨道的电子处于半充满的较稳定状态,比同周期原子序数大1个的VIA的Se元素大,所以Ga、As和Se的第一电离能由大到小的顺序是As>Se>Ga。
(2)在Na3As3中As最外层有5个电子,形成3个共价键即δ键电子对数为3,另外还有1个孤电子对,所以As的杂化方式为sp3;AsCl3中As的价层电子对数=3+![]() (5-1×3)=4,As原子采用sp3杂化,由于孤电子对对成键电子对排斥了强,所以AsCl3分子空间构成三角锥形分子;
(5-1×3)=4,As原子采用sp3杂化,由于孤电子对对成键电子对排斥了强,所以AsCl3分子空间构成三角锥形分子;
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN是因为两种晶体均为原子晶体,且GaN中N原子半径比Ga小,Ga-N 键长比Ga-As短,键能更大,断裂化学键需要的能量大,因此熔点更高;
(4)根据等电子体的概念是原子数相同,最外层电子数也相同的微粒,则SO42-相应的等电子体是CCl4、SiCl4、 SiF4、 CF4;
(5)该晶胞中Ga原子处于与它最近的四个As原子所构成的正四面体的几何中心,因此Ga所处空隙类型为正四面体;在该晶胞中含有的As原子数目为:![]() =4,含有的Ga原子数目为:1×4=4,因此该晶胞在含有4个GaAs,则晶胞的质量为m=
=4,含有的Ga原子数目为:1×4=4,因此该晶胞在含有4个GaAs,则晶胞的质量为m=![]() g,由于晶胞的密度为ρg/cm3,所以晶胞的体积为V=
g,由于晶胞的密度为ρg/cm3,所以晶胞的体积为V=![]() cm3,则晶胞的边长L=
cm3,则晶胞的边长L=![]() cm=
cm=![]() ×1010pm。在该晶体在两个Ga原子之间的距离为晶胞边长的
×1010pm。在该晶体在两个Ga原子之间的距离为晶胞边长的![]() 倍,所以两个Ga原子之间的距离为
倍,所以两个Ga原子之间的距离为![]() ×1010pm。
×1010pm。


科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)写出图中四种实验操作的名称:____、____、____、____。
(2)除去Ca(OH)2 溶液中悬浮的CaCO3__________;
(3)从碘水中提取碘__________;
(4)用自来水制取蒸馏水__________;
(5)分离植物油和水__________;
(6)除去粗盐中的泥沙__________;
(7)与海水晒盐原理相符的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出以下反应的化学反应方程式
①三氧化二铁与稀硫酸反应:______
②氢氧化铝药物治疗胃酸(主要成分为盐酸)过多:______
③氢氧化钠溶液吸收少量二氧化硫气体:______
(2)已知CO和CO2的混合气体18.0g在标准状况下所占的体积为11.2L。则该混合气体中,CO2的物质的量为____mol。
(3)在同温同压下,若A容器中的O2和B容器中的SO2所含的氧原子总数相等,则A容器和B容器的体积比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KNO3固体中含有的少量CaSO4、MgSO4,限选用三种试剂,按下列步骤操作:

(1)写出下列两种试剂的化学式:A____,C____。
(2)根据题意,回答下列问题:
①加入过量A的主要目的是____,
②加热煮沸的目的是___。
(3)操作Ⅰ是____,操作Ⅱ主要是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
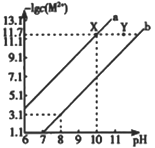
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T______100℃ (填“大于”或“小于”),判断理是_______________________________
b:温度T时反应的平衡常数K2为__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜能被FeCl3的浓溶液腐蚀,其化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2。
现将有铜的印刷线路板浸入120mL FeCl3的溶液中,有9.6 g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。(设溶液体积不变,且不考虑金属离子水解)。
(1)根据9.6g铜被腐蚀,最后溶液中还有4.8g不溶物,说明溶液中肯定还有_____,所以4.8g固体不可能有____,即4.8g是_______。
(2)9.6 g铜被腐蚀生成________ mol Fe2+。
(3)最后溶液中金属离子物质的量浓度c(Cu2+)=______,c(Fe2+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com