
【题目】为了除去KNO3固体中含有的少量CaSO4、MgSO4,限选用三种试剂,按下列步骤操作:

(1)写出下列两种试剂的化学式:A____,C____。
(2)根据题意,回答下列问题:
①加入过量A的主要目的是____,
②加热煮沸的目的是___。
(3)操作Ⅰ是____,操作Ⅱ主要是____。
【答案】Ba(OH)2 HNO3 除尽Mg2+和SO42- 使HNO3挥发 过滤 蒸发浓缩、冷却结晶
【解析】
除去溶液中的可溶性杂质,常加入沉淀剂使其转化为难溶物,再过滤除去。为除尽杂质离子,沉淀剂必须过量;多余的沉淀剂必须在后面的步骤中去除。
(1)固体溶于水所得溶液中杂质离子有Ca2+、Mg2+、SO42-,可分别转化为CaCO3、Mg(OH)2、BaSO4沉淀。为减少新杂质,沉淀剂分别是K2CO3、KOH、Ba(NO3)2,其中KOH、Ba(NO3)2可用Ba(OH)2代替。过量的Ba2+可转化为BaCO3沉淀除去,故K2CO3需在Ba(NO3)2或Ba(OH)2之后加入。过滤后,向滤液中加入稀HNO3可除去多余的OH-、CO32-。限选三种试剂,则A为Ba(OH)2溶液,B为K2CO3溶液,C为HNO3溶液。
(2)①样品溶液中加入过量A[Ba(OH)2溶液],使杂质离子Mg2+、SO42-完全转化为沉淀;
②滤液中加过量稀HNO3后,加热煮沸可使多余的HNO3挥发除去。
(3)从流程图中操作I、II前后的物质看,操作Ⅰ是过滤,操作Ⅱ主要是蒸发浓缩、冷却结晶


科目:高中化学 来源: 题型:
【题目】某混合物气体中各气体的质量分数为O232%、N228%、CO222%、CH416%、H22%,则此混合气体对氢气的相对密度为
A.11.11
B.15.18
C.22.22
D.30.36
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。

(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500mL 0.5mol/L的稀H2SO4,下列说法正确的是
①所需浓H2SO4的体积为13.6mL,可选用20mL量筒量取
②稀释浓硫酸应酸加入水中,且之后立即转移到容量瓶中并加水定容
③为减小误差,应洗涤所用烧杯、玻璃棒和量筒,并将洗涤液转入容量瓶
④定容时俯视,则所配制的溶液浓度偏高
⑤实验中用量筒量取浓硫酸时,仰视读数,则所配制的溶液浓度偏低
A.①③⑤B.②③④C.①④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:

(1)下列实验需要在哪套装置中进行(填序号):
①除去粗盐中的泥沙____;
②与海水晒盐原理相似的是____;
③用四氯化碳从碘水中提取碘____;
④分离互溶的CCl4(![]() 沸点:76.75℃)
沸点:76.75℃)![]() 和苯(
和苯(![]() 沸点:110.6℃)
沸点:110.6℃)![]() 的液体混合物___;
的液体混合物___;
(2)写出以上装置中可被加热的仪器名称为___,需要使用前验漏的玻璃仪器的名称__。
(3)如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),回答下列问题:

①左边大试管中要加入几片碎瓷片,其作用是____;
②该装置中使用的玻璃导管较长,其与如图③中哪种仪器作用相当____;
③烧杯中还要盛有的物质是____。
(4)下列对离子检验的实验过程评价正确的是(_____)
A.某不溶性固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42-
C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
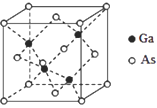
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol·L-1,放出热量b kJ,B中C的浓度分别为
mol·L-1,放出热量b kJ,B中C的浓度分别为![]() mol·L-1,放出热量c kJ。请回答下列问题:
mol·L-1,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小:ω1_____ω2(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500℃时达到平衡后C的浓度为ω3 mol·L-1,则ω1、ω3的关系为_____。
(5)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )

A. pH=7时加入的醋酸溶液的体积大于10 mL
B. C点后继续加入醋酸溶液,水的电离程度减小
C. B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D. Ka(CH3COOH)=5.0×10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com