
【题目】某混合物气体中各气体的质量分数为O232%、N228%、CO222%、CH416%、H22%,则此混合气体对氢气的相对密度为
A.11.11
B.15.18
C.22.22
D.30.36
【答案】A
【解析】
设气体总质量为100g,根据质量分数计算各自质量,再根据n=![]()
计算各自物质的量,根据M=![]()
![]()
计算混合气体的平均摩尔质量,由ρ=![]()
可知,气体的摩尔质量之比等于密度之比,以此解答该题.
设气体总质量为100g,则m(O2)=32g,m(N2)=28g,m(CO2)=22g,m(CH4)=16g,m(H2)=2g,故
n(O2)=![]() =1mol,n(N2)=
=1mol,n(N2)=![]() =1mol,n(CO2)=
=1mol,n(CO2)=![]() =0.5mol,n(CH4)=
=0.5mol,n(CH4)=![]() =1mol,n(H2)=
=1mol,n(H2)=![]() =1mol,
=1mol,
则平均摩尔质量=![]() =22.22g/mol,
=22.22g/mol,
由ρ=MVm可知,气体的摩尔质量之比等于密度之比,则此混合气体对氢气的相对密度为![]() =11.11,
=11.11,
故选A.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组用重铬酸钾测定土壤中的有机质,其反应原理可简化为:2K2Cr2O7+ 3C + 8H2SO4→2Cr2(SO4)3+ 2K2SO4 + 3CO2↑+8H2O
(1)上述反应涉及的元素中,非金属性最强的是________,硫原子核外有________种运动状态的电子。
(2)干冰属于________晶体,该晶体中存在的作用力有________、________。
(3)该反应的氧化剂是________;标准状况下每生成2.24 L CO2转移________个电子。
(4)有小组成员用盐酸代替硫酸进行实验,发现产生了黄绿色气体,该气体为________。产生该气体的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是
A. v(A)=0.6mol/(L·min) B. v(B)=1.2mol/(L·min)
C. v(C)=1.2mol/(L·min) D. v(B)=0.03mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是
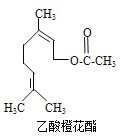
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③ B. ①②⑤ C. ①②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)写出图中四种实验操作的名称:____、____、____、____。
(2)除去Ca(OH)2 溶液中悬浮的CaCO3__________;
(3)从碘水中提取碘__________;
(4)用自来水制取蒸馏水__________;
(5)分离植物油和水__________;
(6)除去粗盐中的泥沙__________;
(7)与海水晒盐原理相符的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


已知:CaO2的制备原理:CaCl2+H2O2+2NH3H2O+6H2O= CaO28H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KNO3固体中含有的少量CaSO4、MgSO4,限选用三种试剂,按下列步骤操作:

(1)写出下列两种试剂的化学式:A____,C____。
(2)根据题意,回答下列问题:
①加入过量A的主要目的是____,
②加热煮沸的目的是___。
(3)操作Ⅰ是____,操作Ⅱ主要是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com