
【题目】下列A、B、C、D是中学常见的混合物分离或提纯的基本装置

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)写出图中四种实验操作的名称:____、____、____、____。
(2)除去Ca(OH)2 溶液中悬浮的CaCO3__________;
(3)从碘水中提取碘__________;
(4)用自来水制取蒸馏水__________;
(5)分离植物油和水__________;
(6)除去粗盐中的泥沙__________;
(7)与海水晒盐原理相符的是__________。
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ.mol-1
2NH3(g) △H=-92.4kJ.mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1___________K2(填“>”、“=”或“<”);
②在同温同压下判断该反应达到化学平衡状态的依据是___________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。

①其阴极的电极反应式为___________。
②常温下,1LpH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=___________mol·L-1。
(4)工业上生产尿素的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
在T℃,体积为4L的密闭容器中,通入6molNH3和3 mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,e(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的V正___________V逆(填“>”“<”或“=”)。再次平衡后,平衡常数为___________。
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.09mo1·L-1的AgNO3溶液中加入50mL0.10mol·L-1的盐酸,混合后溶液中的Ag+的浓度为___________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1993年8月,国际原子量委员会确认我国张青莲教授测定的锑的相对原子质量(121.760)为标准原子量,已知锑有两种以上天然同位素,则121.760是( )
A.锑元素的质量与12C原子质量1/12的比值
B.一个锑原子的质量与12C原子质量1/12的比值
C.按各种锑的天然同位素的相对原子质量与这些同位素所占的一定百分比计算出的平均值
D.按各种锑的天然同位素质量数与这些同位素所占的一定百分比计算出的平均值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物气体中各气体的质量分数为O232%、N228%、CO222%、CH416%、H22%,则此混合气体对氢气的相对密度为
A.11.11
B.15.18
C.22.22
D.30.36
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,氨水中![]() 的电离平衡常数:
的电离平衡常数:![]() 向1L
向1L ![]() 溶液中,不断加入固体NaOH后,
溶液中,不断加入固体NaOH后,![]() 与
与![]() 的变化趋势如图所示
的变化趋势如图所示![]() 溶液体积和温度的变化、氨的挥发均忽略不计
溶液体积和温度的变化、氨的挥发均忽略不计![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()

A. ![]() 的电离方程式为:
的电离方程式为:![]()
B. M点时,![]()
C. ![]()
D. 当![]() mol时,溶液中有:
mol时,溶液中有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应的速率、限度及能量变化具有重要意义。
⑴实验室用锌粒和稀硫酸反应制氢气,能加快反应速率的方法有:______、______。
⑵工业上合成氨反应(N2+3H2![]() 2NH3)中物质的能量随时间的变化如下图所示。
2NH3)中物质的能量随时间的变化如下图所示。

①该反应为______(填“放热”或“放热”)反应。
②若起始N2和H2的体积比为1∶3,控制一定的条件,___(填“能”或“不能”)使反应物的转化率达到100%。
③下列过程放出热量的是______。(填字母)
A.甲烷燃烧
B.碳酸钙分解
C.液氨汽化
D.化学键断裂
⑶图为铜锌原电池示意图。

①原电池工作时的能量转化方式为______。
②原电池工作时,导线中电子的流向为______。
③Cu电极表面的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:

Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。
(已知:![]() )
)
回答下列问题:
(1)反应瓶中前后通入氮气的目的分别是________________、_________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是____,若只使用一个吸收管,会导致测定结果偏____(填“高”或“低”)。
(4)实验室常用FeS固体与酸常温下反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是_______________(填序号)。

(5)上图a中盛装液体药品的玻璃仪器名称为________。
(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
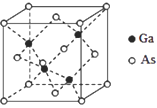
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com