
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
【答案】C
【解析】
A. 0.3mol·L-1A1(NO3)3溶液,但是并没有告诉溶液的体积是多少,故无法计算溶液中含的A13+数,故A错误;
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,该反应是可逆反应,若向某密闭容器中加入NA个氢分子和NA个碘分子,无法完全反应,则充分反应后放出的热量小于akJ,故B错误;
2HI(g) △H=-akJ·mol-1,该反应是可逆反应,若向某密闭容器中加入NA个氢分子和NA个碘分子,无法完全反应,则充分反应后放出的热量小于akJ,故B错误;
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,因为H2--2e-,当正极产生1.12LH2时,即0.05mol H2,则外电路中通过的电子数为0.1NA,故C正确;
D. C2H4和CO的摩尔质量均为28 g/mol,故28 g C2H4和CO的混合气体物质的量为1 mol,混合气体中含有碳原子的数目为在NA和2NA之间,但不一定是1.5NA,故D错误;
答案选C。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】研究化学反应的速率、限度及能量变化具有重要意义。
⑴实验室用锌粒和稀硫酸反应制氢气,能加快反应速率的方法有:______、______。
⑵工业上合成氨反应(N2+3H2![]() 2NH3)中物质的能量随时间的变化如下图所示。
2NH3)中物质的能量随时间的变化如下图所示。

①该反应为______(填“放热”或“放热”)反应。
②若起始N2和H2的体积比为1∶3,控制一定的条件,___(填“能”或“不能”)使反应物的转化率达到100%。
③下列过程放出热量的是______。(填字母)
A.甲烷燃烧
B.碳酸钙分解
C.液氨汽化
D.化学键断裂
⑶图为铜锌原电池示意图。

①原电池工作时的能量转化方式为______。
②原电池工作时,导线中电子的流向为______。
③Cu电极表面的现象为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,试回答下列问题:

(1)下列实验需要在哪套装置中进行(填序号):
①除去粗盐中的泥沙____;
②与海水晒盐原理相似的是____;
③用四氯化碳从碘水中提取碘____;
④分离互溶的CCl4(![]() 沸点:76.75℃)
沸点:76.75℃)![]() 和苯(
和苯(![]() 沸点:110.6℃)
沸点:110.6℃)![]() 的液体混合物___;
的液体混合物___;
(2)写出以上装置中可被加热的仪器名称为___,需要使用前验漏的玻璃仪器的名称__。
(3)如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),回答下列问题:

①左边大试管中要加入几片碎瓷片,其作用是____;
②该装置中使用的玻璃导管较长,其与如图③中哪种仪器作用相当____;
③烧杯中还要盛有的物质是____。
(4)下列对离子检验的实验过程评价正确的是(_____)
A.某不溶性固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
B.某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42-
C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
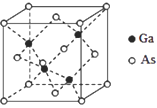
【题目】太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______;S原子的价电子排布式为________;Ga、As和Se的第一电离能由大到小的顺序是________。
(2)Na3As3中As原子的杂化方式为_____;AsCl3的空间构型为____。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________。
(4)写出一种与SO42-互为等电子体的分子_________。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。

①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处![]() =________。
=________。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中发生反应2A2(g)+B2(g)![]() 2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为
2C(g) △H=-a kJ·mol1(a>0),已知P是可自由滑动的活塞。在相同温度下关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达到平衡,A中C的浓度为![]() mol·L-1,放出热量b kJ,B中C的浓度分别为
mol·L-1,放出热量b kJ,B中C的浓度分别为![]() mol·L-1,放出热量c kJ。请回答下列问题:
mol·L-1,放出热量c kJ。请回答下列问题:

(1)若将温度升高到700℃,反应的平衡常数将_____(填“增大”、“减小”、或“不变”)。
(2)比较大小:ω1_____ω2(填“>”、“=”、或“<”),a、b、c由大到小的关系为_____。
(3)若打开K,一段时间后重新达到平衡,容器B的体积将_____(填“增大”、“减小”、或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500℃时达到平衡后C的浓度为ω3 mol·L-1,则ω1、ω3的关系为_____。
(5)使该反应的反应速率增大,且平衡向正反应方向移动的是_____。
a.及时分离出C气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个恒容容器中分别发生反应A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1减小,α2增大 B. α1、α2均增大
C. α1、α2均减小 D. α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
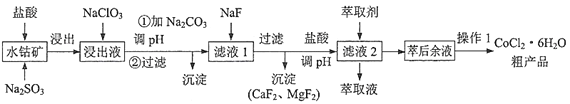
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
②部分阳离子开始沉淀和完全沉淀的pH见下表

③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出Co2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
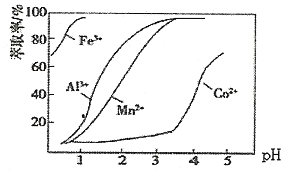
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2·6H2O常用减压烘干法烘干,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1)A所含官能团的名称是_____。
(2)B的分子式为_____;写出同时满足下列条件的B的链状同分异构体的结构简式:_______________。
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
(3) B → C、E → F的反应类型分别为_____、_____。
(4)C → D的化学方程式为_____。
(5) 通过常温下的反应,区别E、F和G的试剂是_____和_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com