
【题目】辣椒的味道主要来自辣椒素类化合物。辣椒素作为一种生物碱广泛用于食品保健、医药工业等领域。辣椒素的合成路线如图:
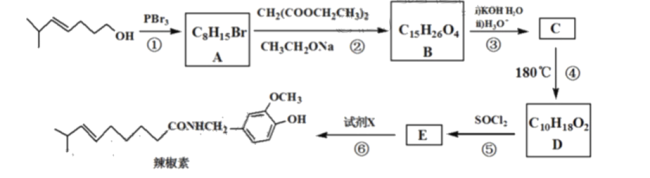
已知:a.-NH2![]() -NHCOCH3;
-NHCOCH3;
b.-CH(COOH)2![]() -CH2COOH+CO2;
-CH2COOH+CO2;
请问答:
(1)下列说法正确的是__。
A.化合物B能发生加成、酯化、氧化、还原反应
B.化合物C能与氢氧化铜发生反应
C.试剂X既能和强酸反应又可以和强碱反应
D.辣椒素的分子式是C18H27NO3
(2)写出C的结构简式__。
(3)写出A+B→C的化学方程式__。
(4)已知:![]() ,请结合题中所给的信息,写出由
,请结合题中所给的信息,写出由![]() 制备
制备![]() 的合成路线流程图(无机试剂任选)。__。
的合成路线流程图(无机试剂任选)。__。
(5)写出试剂X(C8H11NO2)同时符合下列条件的所有同分异构体的结构简式__。
①是苯环上有二种氢,不能使FeCl3显色,IR谱表明分中无N-O键
②1mol该物质与足量Na发生反应放出1molH2(不考虑同一个碳上连2个-OH)
【答案】BCD ![]()
![]()
![]()
![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
根据氢原子个数和氧原子得到①反应是—OH被—Br取代,再根据A、B的分子式和氢原子个数得到A发生取代反应,C—Br键断裂,H—CH(COOCH2CH3)2中前面碳氢键断裂,生成B,B水解生成C,C中含有—CH(COOH)2,再根据信息2得到C的—CH(COOH)2变为—CH2COOH,得到D物质,D变为E,根据前后联系得到E中含有—CH2COCl,根据信息1,E在和X反应生成辣椒素。
⑴A. 化合物B含有碳碳双键和酯基,因此能发生加成、氧化、还原反应,但不能发生酯化,故A错误;B. 化合物C含有羧基,因此能与氢氧化铜发生反应,故B正确;C. 试剂X含有—NH2、酚羟基,因此—NH2与强酸反应,酚羟基和强碱反应,故C正确;D. 辣椒素的分子式是C18H27NO3,故D正确;综上所述,答案为:BCD。
⑵根据前面分析得到C的结构简式![]() ;故答案为:
;故答案为:![]() 。
。
⑶根据A、B的分子式和氢原子个数得到A发生取代反应,C—Br键断裂,H—CH(COOCH2CH3)2中前面碳氢键断裂,生成B,因此A+B→C的化学方程式![]() ;故答案为:
;故答案为:![]() 。
。
⑷![]() 在SOCl2作用下反应生成
在SOCl2作用下反应生成![]() ,
,![]() 在AlCl3作用下反应生成
在AlCl3作用下反应生成![]() ,
,![]() 与氢气在催化剂作用下发生加成反应生成
与氢气在催化剂作用下发生加成反应生成![]() ,
,![]() 在浓硫酸作用下发生消去反应生成
在浓硫酸作用下发生消去反应生成![]() ;因此制备
;因此制备![]() 的合成路线流程图为
的合成路线流程图为
![]() ;故答案为:
;故答案为:![]() 。
。
⑸①是苯环上有二种氢,不能使FeCl3显色,IR谱表明分中无N—O键,说明苯环有两种位置的氢,没有酚羟基,②1mol该物质与足量Na发生反应放出1molH2(不考虑同一个碳上连2个—OH),说明含有两个醇羟基,因此可能的结构简式![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ;故答案为:
;故答案为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇(沸点78.5 ℃),在潮湿环境下易被氧化,温度高于100 ℃开始分解。
I.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填字母代号)。
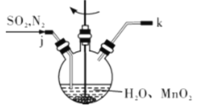
A. MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
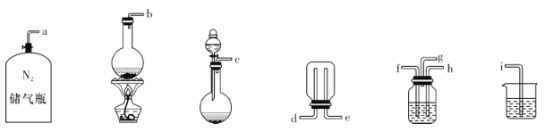
②已知实验室制取SO2的原理是Na2SO3 +2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置的接口顺序为_________(用箭头连接字母代号表示)。
③若用空气代替N2进行实验,缺点是_______________。( 酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②...;.
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②为__________,需要用到的试剂有_____________、_______、________。
II.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:_____________。[查阅资料表明K2(H2SO4)=1.1×10-2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为0.5NA
B.1L0.1mol/L的CH3COONa溶液中含有的CH3COO-数目为0.1NA
C.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2NA
D.标准状况下,16gO2和O3混合物中含有的氧原子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是

A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
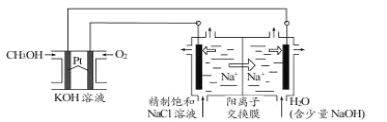
(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH______(填“增大”、“减小”或“不变”),负极反应式为______。
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。阳极产生ClO2的反应式为______。
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______mol。
(4)在阴极室中加入少量的NaOH的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com