
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
【答案】 H+ +OH-=H2O Al(OH)3 +OH-=AlO2-+2H2O 4 0.1 200 透过蓝色钴玻璃观察,火焰呈紫色 CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-
【解析】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体,氢气的物质的量为![]() 0.3mol,根据2Al~~3H2,混合中Al粉的物质的量为0.3mol×
0.3mol,根据2Al~~3H2,混合中Al粉的物质的量为0.3mol×![]() =0.2mol;向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,根据沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系图,可知:(1)OA段酸过量,发生酸碱中和反应,离子反应方程式为H+ +OH-=H2O;继续滴加KOH溶液将溶液里的Al3+和Mg2+转化为Al(OH)3和Mg(OH)2沉淀,BC段滴加KOH溶液,溶解生成的Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3 +OH-=AlO2-+2H2O;
=0.2mol;向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,根据沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系图,可知:(1)OA段酸过量,发生酸碱中和反应,离子反应方程式为H+ +OH-=H2O;继续滴加KOH溶液将溶液里的Al3+和Mg2+转化为Al(OH)3和Mg(OH)2沉淀,BC段滴加KOH溶液,溶解生成的Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3 +OH-=AlO2-+2H2O;
(2)B点为完全沉淀点,此时溶液中溶质K2SO4,根据原子守恒可知n(K+)=2n(SO42-)=2×0.3L×4mol/L=2.4mol,此时消耗KOH溶液体积为0.6L,则c(KOH)=![]() =4mol/L;BC段共消耗KOH溶液体积为0.1L,根据Al(OH)3 +OH-=AlO2-+2H2O可知Al(OH)3 的物质的量为4mol/L×0.1L=0.4mol;设氧化铝的物质的量为n mol,根据原子守恒2n mol+0.2 mol=0.4mol,n=0.1;
=4mol/L;BC段共消耗KOH溶液体积为0.1L,根据Al(OH)3 +OH-=AlO2-+2H2O可知Al(OH)3 的物质的量为4mol/L×0.1L=0.4mol;设氧化铝的物质的量为n mol,根据原子守恒2n mol+0.2 mol=0.4mol,n=0.1;
(3)C点对应的沉淀Mg(OH)2物质的量为 0.2mol,则生成沉淀Mg(OH)2和Al(OH)3 消耗KOH的物质的量为0.2mol×2+0.4mol×3=1.6mol,消耗KOH溶液的体积为![]() =400mL,则A点对应的数值为600mL-400mL=200mL;
=400mL,则A点对应的数值为600mL-400mL=200mL;
(4)K+的检验可用焰色反应,具体操作是透过蓝色钴玻璃观察,火焰呈紫色;
(5)C点对应的溶液中含有AlO2-,通入足量的CO2所发生反应的离子方程式为CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-;


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为____________。
的官能团名称为____________。
(2)已知![]() 的系统命名为2-丙酮酸,则A的名称是 。
的系统命名为2-丙酮酸,则A的名称是 。
(3)D为二元酯,则B→D的化学方程式为 。
(4)D→E的反应历程如下:
![]()
其中属于取代反应的是_________(填序号)![]() 中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
中能与稀NaOH溶液反应的官能团是 。检验该官能团的方法是_________。
(5)写出满足下列条件的D的所有同分异构体的结构简式 。
a.核磁共振氢谱有4组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(6)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯![]() 请写出反应合成线路______________。(无机试剂任用)
请写出反应合成线路______________。(无机试剂任用)
合成线路示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:①SiO2+2C===Si+2CO↑ ②Si+2Cl2===SiCl4
③SiCl4+2H2===Si+4HCl。下列对上述三个反应的叙述中,不正确的是( )
A.①③为置换反应
B.②为化合反应
C.①②③均为氧化还原反应
D.三个反应的反应物中硅元素均被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室拟用浓盐酸与二氧化锰反应制取纯净的氯气。并验证氯气的性质。
(Ⅰ)制取氯气:
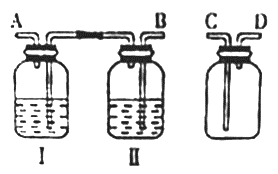
(1)按气体从左到右流动的方向将下列装置进行连接(填字母〉,H→_____、_______→ _______。广口瓶Ⅱ中的试剂为________。
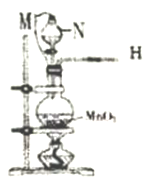
(2)仪器N的名称是_______;M是连通上下玻璃仪器的橡胶管,其目的是__________________;写出圆底烧瓶中发生反应的离子方程式_________________。
(3)连接好仪器后,上述装置存在一个明显的缺陷,你的改进方法是_______________。
(Ⅱ)验证氯气的性质:将从上述发生装置H处导出的气体依次经过下列装置验证氯气的性质(其他相关装置已略去)
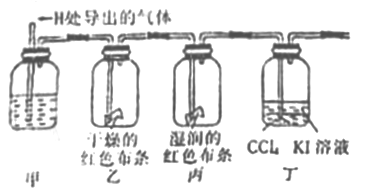
(4)丁中出现的现象是__________________,该反应证明了氯气的____________性。
(5)证明HClO具有漂白性的实验现象是__________________,甲中的试剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.8g的Ag投入一定量的浓硝酸中完全溶解得到NO和NO2的混合气体,用NaOH溶液把该混合气体完全吸收得釗NaNO3和NaNO2的混合溶液,则所得NaNO2的物质的量为
A. 0.05mol B. 0.06mol C. 0.075mol D. 0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是
A.SO2的摩尔质量是64g
B.1molSO2中所含分子数约为6.02×1023
C.1molSO2的质量是64g/mol
D.常温常压下,1molSO2的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5kJ.mol-1, △H2=-395.4kJ.mol-1,下列正确的是

A. C(s、石墨)="=" C(s、金刚石) △H=" +1.9" kJ·mol -1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示。下列说法正确的是( )
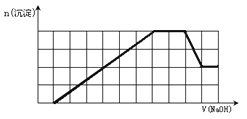
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com