
����Ŀ���Ͻ�������Ͼ�����������������ܣ���������ܵĿ���������Ҫ���á�
��1��һ���¶��£�ij����Ͻ�M�������������ͼ��ʾ������Ϊƽ��ʱ������ѹǿ��p���������ʾ��������ԭ�������ԭ�ӵĸ����ȣ�H/M����
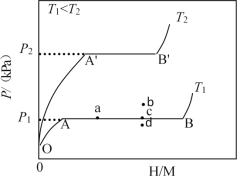
��OA�Σ����ܽ���M���γɹ�����MHx����������ѹǿ������H/M���������AB�Σ�MHx�����������⻯��Ӧ�����⻯��MHy���⻯��Ӧ����ʽΪ��zMHx(s)+H2(g)=ZMHy(s)��H(��)����B�㣬�⻯��Ӧ��������һ����������ѹǿ��H/M�������䡣��Ӧ������z=___���ú�x��y�Ĵ���ʽ��ʾ�����¶�ΪT1ʱ��2gij�Ͻ�4min����������240mL����������v=___mLg-1min����Ӧ���ʱ��H1__0������>����<������=������
��2������ʾ��λ��������Ͻ����⻯��Ӧ�ε����������ռ�����������ı��������¶�ΪT1��T2ʱ������T1��____����T2��������>����<������=����������Ӧ������ͼ��a��ʱ�������¶Ȳ��䣬�������ϵ��ͨ�������������ﵽƽ���Ӧ�����ܴ���ͼ�е�___�㣨����b����c������d������������Ͻ��ͨ��___��___�ķ�ʽ�ͷ�������
���𰸡�![]() 30 < > c ���� ��ѹ
30 < > c ���� ��ѹ
��������
��1���⻯��Ӧ����ʽΪ��zMHx(s)+H2(g)![]() zMHy(s)������ԭ���غ�ɵ�z��x+2=z��y���Ӷ����z=2/(y��x)����������v=240mL��2g��4min=30mLg��1min��1������Ϊƽ��ʱ������ѹǿ��p���������ʾ��������ԭ�������ԭ�ӵĸ����ȣ�H/M������ͼ��֪��T1<T2��T2ʱ������ѹǿ��Ҳ����˵H2�����ʵ����࣬˵�������¶�������H2�ķ����ƶ�����������ӦΪ���ȷ�Ӧ��H<0���ʴ�Ϊ��2/(y��x)��30��<��
zMHy(s)������ԭ���غ�ɵ�z��x+2=z��y���Ӷ����z=2/(y��x)����������v=240mL��2g��4min=30mLg��1min��1������Ϊƽ��ʱ������ѹǿ��p���������ʾ��������ԭ�������ԭ�ӵĸ����ȣ�H/M������ͼ��֪��T1<T2��T2ʱ������ѹǿ��Ҳ����˵H2�����ʵ����࣬˵�������¶�������H2�ķ����ƶ�����������ӦΪ���ȷ�Ӧ��H<0���ʴ�Ϊ��2/(y��x)��30��<��
��2����ͼ��֪���¶�T2��ƽ��ʱ������ѹǿ��˵����ʱ�������٣�����T1��>����T2��������Ӧ������ͼ��a��ʱ�������¶Ȳ��䣬�������ϵ��ͨ������������ƽ�����ƣ�H/M�������������¶Ȳ��䣬ƽ�ⳣ��K=1/[H2]���䣬�ó�����Ũ�Ȳ��䣬����Ϊ�Ǻ�����ϵ���������������ʵ������䣬����ƽ��ʱ����ѹǿ�Ա��ֲ��䣻����ƽ���ƶ�ԭ�����������»��Сѹǿʹƽ�����ƣ��ͷ��������ʴ�Ϊ�����ȣ���ѹ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʰ�������[(NH2CH2COO)2Fe]��һ�ֲ���ǿ������ijѧϰС������FeCO3��ʰ���(NH2CH2COOH)�Ʊ��ʰ���������ʵ��װ������ͼ��ʾ(�гֺͼ���������ʡ��)��
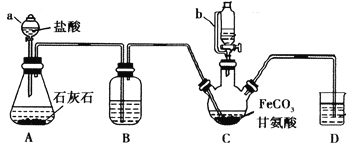
�й������������±���
�ʰ��� | ������ | �ʰ������� |
������ˮ�������Ҵ� | ������ˮ���Ҵ� | ������ˮ���������Ҵ� |
���Ի����� | ǿ���ԡ�ǿ��ԭ�� |
ʵ����̣�
I���ϳɣ�װ��C��ʢ��0.1mol FeCO3��200mL1.0mol��L-1�ʰ�����Һ�����������ᡣʵ��ʱ���ȴ�����a�Ļ�������װ��c�п����ž����Ȳ����Ͻ��裬��ͨ������b��C�м�����������������Һ����p�ȵ�6���ң�ʹ��Ӧ���ַ�Ӧ��
�������룺��Ӧ�������ˣ�����Һ��������Ũ����������ˮ�Ҵ������ˡ�ϴ�Ӳ����
�ش��������⣺
��1������a��������________����a��ȣ�����b���ŵ���_____________________________��
��2��װ��B��ʢ�е��Լ���____________��ʵ�������װ��D�ĵ���һֱû��Һ���µı�Ҫ����___________________________________________��
��3���ϳɹ��̼���������������Ǵٽ�FeCO3�ܽ��________________________ ��
��4����������������Һ����pH������6���ʰ������������½���ԭ��������ӷ���ʽ��ʾΪ________��
��5������II�м�����ˮ�Ҵ���Ŀ����_______________________��
��6�������Ʒ���Ƿ���Fe3+���Լ�������_________ ��
��7����ʵ���Ƶ�15.3g�ʰ���������M=204g/mol�������������_____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1����Ȼ������Ҫ�ɷ���_____��д��ѧʽ��������ӿռ乹����_____��
��2������Һ��������Ϊ����ʱ������Ӧ�Ļ�ѧ����ʽ_____����Ӧ����Ϊ_____��
��3��д��Na��ˮ��Ӧ�����ӷ���ʽ_____��
��4��CH2��CH��CH��CH2��H2��һ�������·���1��4���ӳɷ�Ӧ�Ļ�ѧ����ʽ_____��
��5�����Ľṹ��ʽ��![]() �������ʽ_____��һ�ȴ�����_____�֡�
�������ʽ_____��һ�ȴ�����_____�֡�
��6��ijĦ������Ϊ42gmol��1������A��ʹ��ˮ��ɫ��A�Ľṹ��ʽΪ_____��A��һ�������¿��Է����Ӿ۷�Ӧ������Ľṹ��ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У����������Ȳ���������Ȼ��������ܽ⡱������ǣ� ��
A. ��ϡ��������μ��������![]() ��Һ
��Һ
B. ��![]() ��Һ����μ������ϡ
��Һ����μ������ϡ![]() ��Һ
��Һ
C. ��![]() ��Һ����μ���ϡ��ˮ
��Һ����μ���ϡ��ˮ
D. ������������Һ��ͨ�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������23V)���ҹ��ķ��Ԫ�أ��㷺���ڴ���������ҵ���ش��������⣺
��1������Ԫ�����ڱ��е�λ��Ϊ_______����۲�����Ų�ͼΪ____________��
��2������ij��������ľ����ṹ��ͼ1��ʾ��������ʵ��ӵ�е����������Ӹ����ֱ�Ϊ____��_____��
��3��V2O5������SO2ת��ΪSO3�Ĵ�����SO2������Sԭ�Ӽ۲���Ӷ�����__�ԣ����ӵ����幹��Ϊ___��SO3��̬Ϊ�����ӣ��÷�����Sԭ�ӵ��ӻ��������Ϊ____��SO3�������廷״�ṹ��ͼ2��ʾ���ýṹ��Sԭ�ӵ��ӻ��������Ϊ___���ýṹ��S��O���������࣬һ�����Լ140pm����һ�����ԼΪ160pm���϶̵ļ�Ϊ__����ͼ2����ĸ)���÷����к���___��������

��4��V2O5�ܽ���NaOH��Һ�У��ɵõ������ƣ�Na3VO4)�����������ӵ����幹��Ϊ___��Ҳ���Եõ�ƫ�����ƣ��������ӳ���ͼ3��ʾ��������״�ṹ����ƫ�����ƵĻ�ѧʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƿ���Ϊ���ȼ�����֪25.0 mL 0.100 mol��L��1 Na2S2O3��Һǡ�ð�112 mL Cl2����״���£���ȫת��ΪCl�����ӣ���S2O32����ת����
A.SO42��B.SO32��C.SD.S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫 a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵��������ǣ� ��

A. ��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B. ��ع���ʱ�����·������ 0.02 mol ���ӣ��������ϼ��� 0.14 g
C. ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D. ��س��ʱ��Խ���������Li2S2����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣�ɴ˿�֪��______________��_______________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ����˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣

������B��������____________________��
�ڽ�����ʵ�����������ȷ����___________________�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K1��K2
d.��K1��K2������ͨ��N2 e.����A f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=________________����ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3��Ϊ̽�����������ķֽ�������2�����Ѻ��ص�װ��A������ͼ��ʾ��װ���У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��

��C��D�е���Һ����Ϊ_________�����ţ���C��D��������ð�������ɹ۲쵽������ֱ�Ϊ_______________��
a��Ʒ�� b��NaOH c��BaCl2 d��Ba(NO3)2 e��ŨH2SO4
��д�������������·ֽⷴӦ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
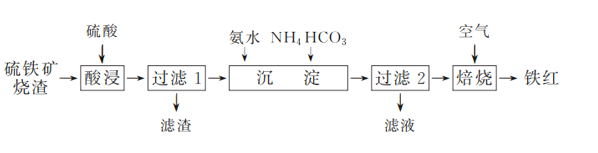
����Ŀ������(Fe2O3)���������ᡢ��ī����ҵ����ҵ����һ������������������(��Ҫ�ɷ�ΪFe2O3��Fe3O4������������������)Ϊ��Ҫԭ���Ʊ������һ�ֹ����������£�
��֪��ijЩ����Ԫ��(��Cu��Fe��Ag��)����������NH3��H2O��OH����SCN�����γɿ���������
(1) ��ҵ������������������������ٽ��������������Ŀ����________��
(2) �������ʱ���������˹���̫���ԭ����________��
(3) ������1��������Һ�к��е���������________��
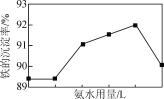
(4) �������������У�����NH4HCO3�������䣬���ij������氱ˮ�����仯����ͼ��ʾ������ˮ��������һ�����ʱ�����ij������½�������ܵ�ԭ����________��
(5) ������2��������������Ҫ�ɷ�ΪFeOOH��FeCO3��������Һ�е���Ҫ������________(�ѧʽ)��
(6) д��FeCO3�ڿ����б�����������Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com