
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
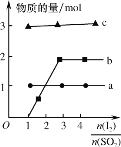
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
【答案】(E1+E3)-(E2+E4) 25% 随着Y值增加φ(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)逆移
CH3OH(g)逆移 ![]() amol HSO4- I3- 减小
amol HSO4- I3- 减小![]() 的投料比
的投料比
【解析】
(1)反应热=反应物总键能-生成物总键能;
(2)①依据题意建立三段式求解可得;
②该反应为放热反应,升高温度,平衡向逆反应方向移动;
(3)四氧化三铅和氢碘酸发生氧化还原反应制备生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O;
(4)根据图象b为从零越来越大的离子,a为不变的离子,结合反应过程分析判断;减小![]() 的投料比能提高碘的还原率。
的投料比能提高碘的还原率。
(1)反应热=反应物总键能-生成物总键能,由题给键能数据可知△H=(E1+E3)-(E2+E4),故答案为:(E1+E3)-(E2+E4);
(2)①设CO的转化率为x,由题意建立如下三段式:
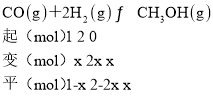
由平衡时CH3OH的体积分数为10%可得![]() ×100%=10%,x=0.25即25%,故答案为:25%;
×100%=10%,x=0.25即25%,故答案为:25%;
②该反应为放热反应,升高温度,平衡向逆反应方向移动,由图可知,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,说明平衡向逆反应方向移动,则Y表示温度,故答案为:随着Y值增加φ(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)逆移;
CH3OH(g)逆移;
(3)四氧化三铅中铅元素的化合价为+![]() 价,碘化铅中铅元素的化合价为+2价,铅元素化合价降低,反应中四氧化三铅作氧化剂,HI作还原剂,碘元素化合价-1价变化为0价,生成I2,则四氧化三铅和氢碘酸发生氧化还原反应生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O,由方程式可知每生成3molPbI2的反应中电子转移2mol,则生成amolPbI2转移电子的物质的量为
价,碘化铅中铅元素的化合价为+2价,铅元素化合价降低,反应中四氧化三铅作氧化剂,HI作还原剂,碘元素化合价-1价变化为0价,生成I2,则四氧化三铅和氢碘酸发生氧化还原反应生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O,由方程式可知每生成3molPbI2的反应中电子转移2mol,则生成amolPbI2转移电子的物质的量为![]() amol,故答案为:
amol,故答案为:![]() amol;
amol;
(4)由图象可知,b为从零越来越大的离子,结合反应原理为SO2+I2+2H2O=3H++HSO4-+2I-和I2+I-![]() I3-可知反应中越来越多的离子为I3-,反应过程中氢离子和硫酸氢根离子始终不变,但氢离子的物质的量是硫酸氢根的3倍,则图中曲线a、b分别代表的微粒是HSO4-、I3-;由图可知,要提高碘的还原率,除控制温度外,还可以采取的措施是减小
I3-可知反应中越来越多的离子为I3-,反应过程中氢离子和硫酸氢根离子始终不变,但氢离子的物质的量是硫酸氢根的3倍,则图中曲线a、b分别代表的微粒是HSO4-、I3-;由图可知,要提高碘的还原率,除控制温度外,还可以采取的措施是减小![]() 的投料比,故答案为:HSO4-;I3-;减小
的投料比,故答案为:HSO4-;I3-;减小![]() 的投料比。
的投料比。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价
是_________,该反应中氧化剂和还原剂的物质的量之比为_____________。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色MnO2沉淀生成。
①ClO2和MnO2均属于氧化物,理由是___________________。
②该反应的离子方程式为_____________________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mg L-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,其关系如下图所示:

①实验中使用的C1O2溶液的物质的量浓度为____________(保留三位有效数字);要使NO的去除率更高,应控制的条件是__________________________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaC1O2,写出碱性条件下NaClO2脱除NO反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2SO2+O2![]() 2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
2SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“ 减小”或“不变”)。
编号 | 改变的条件 | 生成的SO3的速率 |
① | 降低温度 | _______ |
② | 升高温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 恒容下充入Ne | _______ |
⑤ | 压缩体积 | _______ |
⑥ | 使用催化剂 | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)为尽量少引入杂质,试剂①应选用________(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的醋酸,某学生用0.1000 mol·L-1 NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验编号 | 待测醋酸的体积/mL | NaOH溶液的浓度/mol·L-1 | 消耗NaOH溶液的体积/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
(1)该实验中指示剂最好选用___________,滴定达到终点的标志是_____________________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度为_________mol·L-1(保留小数点后4位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关
查看答案和解析>>
科目:高中化学 来源: 题型:
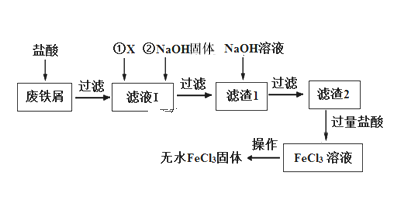
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:
已知:氢氧化物的Ksp如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X可以选用下列物质中的____(选填序号)
A.NaCl B.FeCl3 C.H2O2 D.H2SO4
(2)滤液Ⅰ加入NaOH固体的目的是调节溶液的pH(忽略加入NaOH固体以后溶液体积的变化)。已知滤液Ⅰ中c(Fe3+)为1.0 mol·L-1,c(Al3+)为0.03 mol·L-1,c(Mg2+)为0.01 mol·L-1,当Fe3+恰好沉淀完全时[c(Fe3+)=1×10-5 mol·L-1],Al3+是否已经开始沉淀______(填“是”或“否”)。
(3)写出滤渣1加NaOH溶液发生反应的离子方程式_____________________。
(4)生产流程中最后“从FeCl3溶液得到无水FeCl3固体”的操作分为两步:第一步,先冷却结晶得到FeCl3·6H2O晶体;第二步,制无水FeCl3固体。第二步的正确操作是_____。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是____________________(用离子方程式表示)
②通过控制条件生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
a.降温 b.加氨水 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,弱电解质的电离平衡常数![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂
B.0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中![]()
D.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,aA+bB![]() cC的可逆反应达到平衡:
cC的可逆反应达到平衡:
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则a、b、c的关系是:_____。
(2)已知A为固体、B为无色气体、C是有色气体,且(a+b)=c,在加压时,平衡向____方向移动,气体的颜色将___(填“加深”或“变浅”或“不变”)。
(3)加热后C的质量分数减少,则正反应是___热反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com