
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
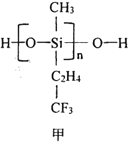
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
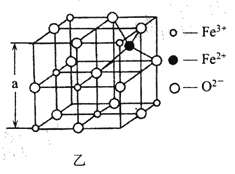
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)
【答案】3d54s1 哑铃 O TiF4为离子晶体,而TiCl4、TiBr4、TiI4均为分子晶体,且组成结构相似,随相对分子质量的增大,分子间作用力逐渐增大,熔点升高 V形 sp3 HClO、HClO2、HClO3、HClO4分子结构中羟基数均为1,而含有的非羟基O原子数目分别为0、1、2、3,使中心原子Cl的核对电子的吸引力逐渐增大,故酸性逐渐增强 是 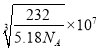
【解析】
(1)Cr的核电荷数为24,基态Cr 原子的电子排布式为[Ar]3d54s1;
(2)基态Si原子的电子排布式为1s22s22p63s23p2;元素的非金属性越强,电负性越大;
(3)①TiF4为离子晶体,而TiCl4、TiBr4、TiI4均为分子晶体,离子晶体的熔点一般比分子晶体高;
②OF2 分子的中心原子为 O 原子,价电子对数为2+![]() =4;
=4;
③无机含氧酸分子结构中非羟基氧原子数越多,酸性越强;
(4)①根据晶体中的氧离子的堆积方式判断;
②先结合晶体的结构计算晶胞的质量,再结合![]() 计算晶胞的体积,即可计算a的长度。
计算晶胞的体积,即可计算a的长度。
(1) Cr的核电荷数为24,基态C r 原子的电子排布式为[Ar]3d54s1,则价层电子的电子排布式为3d54s1;
(2) Si元素为14 号元素,核电荷数为 14,核外电子排布式为 1s22s22p63s23p2,最高能级为3p 能级,3p 能级电子云轮廓图为哑铃形;非金属性: O>C>Si>H,则H、C、O、Si 四种元素中的电负性最高的是O;
(3)①由图表数据可知,TiF4熔点明显高于TiCl4、TiBr4、TiI4,说明TiF4为离子晶体,TiCl4、TiBr4、TiI4均为分子晶体,且TiCl4、TiBr4、TiI4组成结构相似,随相对分子质量的增大,分子间作用力逐渐增大,熔点升高;
②OF2 分子的中心原子为 O 原子,价电子对数为2+![]() =4,则O原子杂化方式为sp3杂化,空间构型为V形;
=4,则O原子杂化方式为sp3杂化,空间构型为V形;
③HClO、HClO2、HClO3、HClO4分子结构中羟基数均为1,而含有的非羟基O原子数目分别为0、1、2、3,使中心原子Cl的核对电子的吸引力逐渐增大,故酸性逐渐增强;
(4)①由晶体结构可知,晶体中的氧离子按ABCABCABC···的方式堆积,属面心立方最密堆积;
②晶胞中Fe3+的数目为4×![]() +3×
+3×![]() =2,Fe2+的数目为1,O2-的数目为12×
=2,Fe2+的数目为1,O2-的数目为12×![]() +1=4,则晶胞的质量为
+1=4,则晶胞的质量为![]() g,晶胞的体积为(a×10-7)3 cm -3,结合
g,晶胞的体积为(a×10-7)3 cm -3,结合![]() 可知a=
可知a=![]() nm=
nm= nm。
nm。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,反应N2+3H2![]() 2NH3达到平衡的标志是( )
2NH3达到平衡的标志是( )
A.一个N≡N键断裂的同时,有三个H-H键形成
B.一个N≡N键断裂的同时,有三个H-H键断裂
C.一个N≡N键断裂的同时,有三个N-H键断裂
D.一个N≡N键断裂的同时,有六个N-H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究发现药物肉桂硫胺(M)可能对2019-nCoV有效,是抗击新型冠状病毒潜在用药,以芳香烃A为原料,合成肉桂硫胺路线如图:
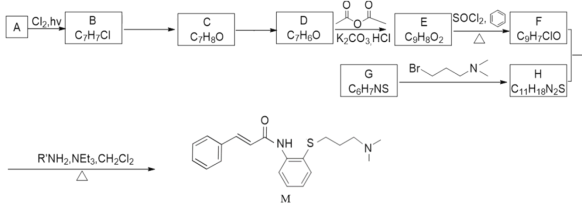
已知: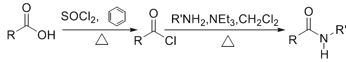
回答下列问题:
(1)A的名称为___。B→C的试剂和条件为__。
(2)C中含有的官能团名称为__。
(3)有机物D与新制的Cu(OH)2悬浊液加热煮沸产生砖红色沉淀的化学方程式是__。
(4)E反式结构简式为__,F最多有__个原子共平面。
(5)G→H的化学方程式为__,G→H的反应类型为__。
(6)J是E的同分异构体,满足下列条件的J的结构有___种;
①J能与溴水发生加成反应②J水解产物遇到FeCl3溶液显紫色
其中苯环上有两种化学环境的氢的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解质溶液的导电能力与离子浓度和离子所带电荷数均呈正相关。在两份等物质的量浓度且等体积的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
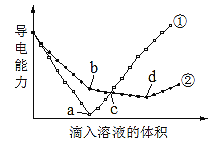
A.①代表滴加NaHSO4溶液的变化曲线
B.反应到b点时,过滤,向滤液中滴加溶液,发生反应的离子方程式为![]()
C.c点两溶液导电能力相同,所以两溶液中含有等物质的量浓度的OH—
D.a点对应的溶液显中性,d点对应的溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1L未知成分的混合溶液,其中除了含有0.2mol/L的Na+外,还可能含有下列离子中的一种或几种:
![]()
现进行如下实验操作(每次实验所加试剂均过量):
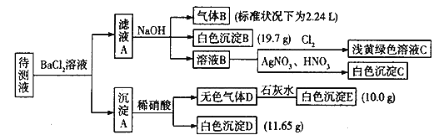
已知:①![]() ,②
,②![]() ,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
,Cl2在常温下为黄绿色气体,可溶于水,其水溶液为浅黄绿色;Br2在常温下是深红棕色液体,微溶于水,其水溶液为黄色。
(1)由气体B可确定待测液中含有的离子是____________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有_____离子,据此可以排除的离子是_____。
(3)由白色沉淀B可确定待测液中含有的离子是____,写出产生沉淀B的离子方程式_______。
(4)某同学读图后,认为待测液中一定不含Br—,他的判断依据是______。
(5)综合分析,待测液中![]() 的物质的量浓度的取值范围为________。
的物质的量浓度的取值范围为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.![]() 离子中心原子上的孤电子对数是1,立体构型为平面三角形
离子中心原子上的孤电子对数是1,立体构型为平面三角形
B.元素周期表第三周期主族元素中,简单离子半径最小的是![]()
C.金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定
D.![]() 、
、![]() 都是非极性分子
都是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
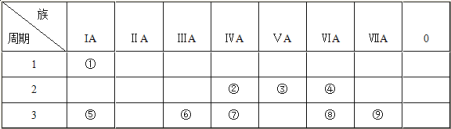
(1)④、⑤、⑧三种元素中,离子半径由大到小的顺序为____(填离子符号)。
(2)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ (填化学式)。⑧和⑨元素的气态氢化物稳定性顺序为__________。
(3)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____。
(4)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式________。
(5)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_________。
(6)能说明⑧的非金属性比⑨的非金属性______(填“强”或“弱”)的事实是__________(用离子方程式说明)。
(7)①和③形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的电子式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
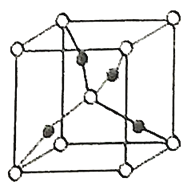
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱图如下图所示,下列说法中不正确的是( )
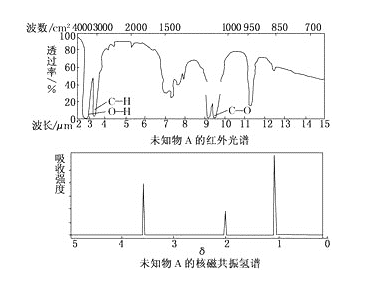
A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子
C. 仅由其核磁共振氢谱图无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com