
【题目】一定条件下,反应N2+3H2![]() 2NH3达到平衡的标志是( )
2NH3达到平衡的标志是( )
A.一个N≡N键断裂的同时,有三个H-H键形成
B.一个N≡N键断裂的同时,有三个H-H键断裂
C.一个N≡N键断裂的同时,有三个N-H键断裂
D.一个N≡N键断裂的同时,有六个N-H键形成
【答案】A
【解析】
A、一个N≡N键断裂,说明反应向正反应方向进行,有三个H-H键形成,说明反应向逆反应方向进行,1个N≡N为1个N2分子,三个H-H为3个H2,符合化学计量数之比,即一个N≡N键断裂的同时,有三个H-H键形成,说明正反应速率等于逆反应速率,达到化学平衡,故A符合题意;
B、N≡N断裂和H-H的断裂,反应都向正反应方向进行,一个N≡N键断裂的同时,有三个H-H键断裂,说明正反应速率不等于逆反应速率,反应未达到平衡,故B不符合题意;
C、1个NH3分子中含有三个N-H键,1个N≡N为1个N2分子,三个N-H为1个NH3分子,不符合化学计量数之比,一个N≡N键断裂的同时,有三个N-H键断裂,说明正反应速率不等于逆反应速率,反应未达到平衡,故C不符合题意;
D、反应都是向正反应方向进行,一个N≡N键断裂的同时,有六个N-H键形成,说明正反应速率不等于逆反应速率,反应未达到平衡,故D不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】近年全球气候变暖,造成北极冰川大面积融化,其罪魁之一就是CO2,如何吸收大气中的CO2,变废为宝,是当今化学研究的主题之一。
I.二甲醚可用作溶剂、冷冻剂喷雾剂等,科学家提出利用CO2和H2合成二甲醚,反应原理为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H
CH3OCH3(g)+3H2O(g) H
(1)已知:①H2O(g)+CO(g)![]() CO2(g)+H2(g) △H1=+42kJ/mol
CO2(g)+H2(g) △H1=+42kJ/mol
②CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) H2=+24.52kJ/mol
2CH3OH(g) H2=+24.52kJ/mol
③CH3OH(g)![]() CO(g)+2H2(g) H3=+90.73kJ/mol
CO(g)+2H2(g) H3=+90.73kJ/mol
则H=__kJ/mol。
(2)一定温度下,在一个2L的密闭容器中充入2molCO2和6molH2发生上述反应,经过5min反应达到平衡,此时容器中压强与起始压强之比为3:4,则用CH3OCH3表示的平均反应速率为__,H2的转化率为___;此时若向体系中再加入2molCO2和1.5molH2O(g),平衡__移动(填正向、逆向、不)。
(3)对于恒温恒容条件下进行的反应①,下列说法能说明反应已达平衡的是__。
A.混合气体密度不发生改变
B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=v(H2)逆
D.n(CO)与n(H2)的比值不变
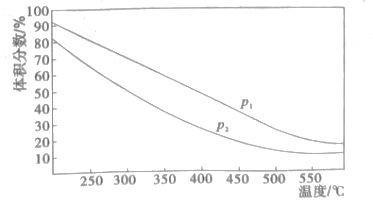
(4)一定温度下,密闭容器中进行的反应③,测得平衡时混合物中某物质的体积分数在不同压强下随温度的变化如图所示,则纵坐标表示的物质是__,压强P1_P2(填>、<)。
II.工业锅炉长期煮烧会形成锅垢(主要成分CaSO4、Mg(OH)2),必须定期除去。
(5)CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO32-=CaCO3+SO42-,室温下,该反应的化学平衡常数为__(室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
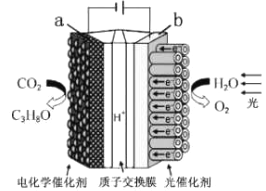
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。( )
A. 58% B. 42% C. 36% D. 64%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年4月23日,中国人民军成立70周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。航母的龙骨要耐冲击,甲板要耐高温,外壳要耐腐蚀.
(1)镍铬钢抗腐蚀性能强,基态C r 原子价层电子的电子排布式为_______________。
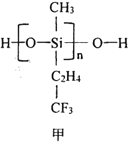
(2)航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图申所示)。基态Si原子电子占据最高能级的电子云轮廓图为_______形:H、C、O、Si 四种元素中的电负性最高的是______。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①钛卤化物的熔点如下表所示:
TiF4 | TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | 377 | -24 | 38 | 150 |
解释表中卤化物之间熔点差异的原因是________________________。
②OF2的空间构型为___________,其中O原子杂化方式为__________杂化。
③氯元素可以形成多种含氧酸,其酸性由弱到强的顺序为:HClO <HClO2<HClO3<HClO4。试解释其酸性强弱的原因是_______________ 。
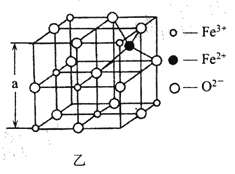
(4)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏大着极的资源,含有硅、氧、锰、锌等。如图是从铁氧体离子晶体Fe3O4 中取出的能体现其晶体结构的一个立方体。
①晶体中的氧离子是否构成了面心立方最密堆积?________(填“是”或“否”);
②已知:Fe3O4 晶体的密度为5. 18gcm -3, 根据该图计算a________nrn (写出计算式即可,阿伏加德罗常数的值为N A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com